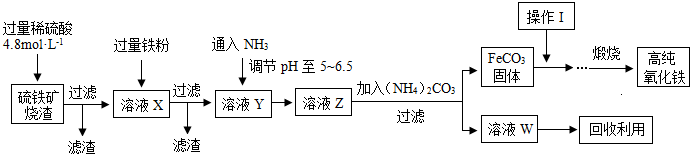
题目内容
(14分).实验室用需配制250mL0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的Na2CO3溶液
|
实际应称Na2CO3质量/g |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
|
|
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ___ _____;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确量取所需的碳酸钠的质量,加水(约30mL)溶解
C.将溶解液注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.逐滴加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 ,
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作 ,若加蒸馏水时不慎超过了刻度 ,若定容时俯视刻度线___________________,称量时游码和物体位置放错 ,Na2CO3 含有少量结晶水 。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度 ;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面 。
(1) 2.7g , 250 ml , 玻璃棒、烧杯、胶头滴管
(2)B C A F E D
(3)将所有碳酸钠移入容量瓶
(4)偏低, 偏低 ,偏高,偏低,偏低
(5)重新配制,重新配制
【解析】

(1)提出合理的假设:该酸雨中的溶质除H2SO4、HC1外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有
(2)设计实验方案验证以上假设.在答题卡上写出实验步骤、预期现象和结论.限选试剂及仪器:盐酸、硝酸、BaC12溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用 | 无明显现象 |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤 | 有白色沉淀 |
| 步骤3:取少量步骤2得到的滤渣加入过量盐酸 | 滤渣不能完全溶解,说明酸雨中含有硫酸 |
| 步骤4:取适量步骤2得到的滤液, |
|
| 步骤5:往B试管中加入 |
①标准溶液配制:实验室用1.000mol?L-1较浓的碘水配制250mL 0.02000mol?L-1的碘水溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需
②滴定:准确量取25.00mL该酸雨于锥形瓶中,加入几滴
计算:被碘水氧化的物质的量浓度之和为
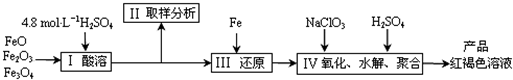
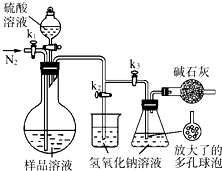 (2013?江苏三模)碳酸钠-过氧化氢加合物(aNa2CO3?bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
(2013?江苏三模)碳酸钠-过氧化氢加合物(aNa2CO3?bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下: