题目内容
3.以下有关NO2气体的描述中正确的是( )| A. | 据反应3NO2+H2O═2HNO3+NO可知,NO2是HNO3的酸酐 | |
| B. | 据反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O和3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,可知浓HNO3的氧化性不如稀HNO3强 | |
| C. | 据反应2NO2(g)?N2O4(g)△<0可知要制得较纯净的NO2,需高温、低压环境 | |
| D. | NO2、Br2(g)同为红棕色气体,可用湿润的淀粉-KI试纸鉴别 |
分析 A.酸酐中元素化合价和酸中元素化合价相同;
B.浓硝酸影响大于稀硝酸;
C.反应是气体体积减小的放热反应,升温、减小压强平衡逆向进行;
D.二氧化氮和溴单质都是强氧化剂都可以氧化碘离子生成碘单质.
解答 解:A.二氧化氮和水反应生成硝酸,同时生成一氧化氮,氮元素化合价改变,不是硝酸的酸酐,硝酸酸酐为N2O5,故A错误;
B.依据化学平衡分析可知3NO2+H2O?2HNO3+NO,当硝酸难度增大平衡逆向进行,生成二氧化氮,当硝酸浓度减小,平衡正向进行,生成一氧化氮,浓硝酸氧化性大于稀硝酸,故B错误;
C.据反应2NO2(g)?N2O4(g)△H<0可知反应为气体体积减小的放热反应,要制得较纯净的NO2,需要改变条件平衡逆向进行,所以需高温、低压环境,故C正确;
D.NO2、Br2(g)同为红棕色气体,都具有氧化性,能氧化碘离子为碘单质,淀粉变蓝,不能用湿润的淀粉-KI试纸鉴别,故D错误;
故选C.
点评 本题考查了酸酐、氧化性强弱比较、化学平衡影响因素分析、物质性质等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.将钠、铝、铁各1mol分别投入到等体积且同浓度的盐酸中,产生的氢气体积在相同条件下( )
| A. | 钠可能最多 | B. | 铝铁不可能一样多 | ||
| C. | 铝一定最多 | D. | 无法判断 |
14.下列有关描述正确的是( )
| A. | 两种同位素137Cs和133Cs形成的单质化学性质几乎完全相同 | |
| B. | 非金属元素的原子半径越小越容易得电子,该元素最高价氧化物的水化物酸性一定也越强 | |
| C. | 随原子序数的增大,碱金属元素单质的密度逐渐增大,ⅦA元素的单质的熔沸点逐渐升高 | |
| D. | 主族元素A、B、C、D的离子aA2+、bB+、cC2-、dD-(n为正整数)具有相同的电子层结构,则原子序数大小关系为a>b>c>d |
18.把一定质量的铁完全溶解于某浓度的硝酸中收集到0.3mol NO2和0.2mol NO.向反应后的溶液中加入足量NaOH溶液充分反应,经过滤、洗涤后,把所得沉淀加热至质量不再减少为止.得到固体质量不可能为( )
| A. | 18 g | B. | 24 g | C. | 30 g | D. | 36 g |
8.下列反应既是氧化还原反应,又是吸热反应的是( )
| A. | 铝片与稀H2SO4反应 | B. | 灼热的炭与CO2反应 | ||
| C. | 高温煅烧石灰石 | D. | 甲烷在O2中的燃烧反应 |
15.在化学学习中使用数轴的表示方法可收到直观、形象的效果,下列表达中正确的是( )
| A. | 分散质微粒的大小与分散系种类的关系: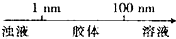 | |
| B. | 常温下溶液的pH其酸碱性的关系: | |
| C. | 硫的化合物中化合价与其氧化性、还原性的关系: | |
| D. | Na与O2反应的产物: |
12.原子利用率=期望产物的总质量与生成物的总质量之比,原子利用率越高对环境污染越小.在下列制备环氧乙烷的反应中,原子利用率最高的是( )
| A. |  $\stackrel{催化剂}{→}$ $\stackrel{催化剂}{→}$ +HOCH2═O═CH2OH+2H2O +HOCH2═O═CH2OH+2H2O | B. | CH2═CH2+Cl2+Ca(OH)2? +CaCl2+H2O +CaCl2+H2O | ||
| C. | CH2═CH2+ (过氧乙酸)? (过氧乙酸)? +C3HCOCH +C3HCOCH | D. | 2CH2═CH2+O2$\stackrel{催化剂}{→}$ |
