题目内容
5.下列实验装置正确且能完成实验目的是( )| A. |  制取SO2并检验SO2的漂白性 | B. |  提取海带中的碘 | ||
| C. |  检验火柴燃烧产生的SO2 | D. |  证明非金属性:Cl>C>Si |
分析 A.加热条件下浓硫酸和铜反应生成二氧化硫,二氧化硫可与品红褪色,可与碱溶液反应;
B.海带中碘以离子存在,先氧化后萃取,且分液时分液漏斗的下端紧靠烧杯内壁;
C.图中拉针筒,可将液体吸入针筒;
D.盐酸为无氧酸,且盐酸挥发,盐酸与硅酸钠反应.
解答 解:A.加热条件下浓硫酸和铜反应生成二氧化硫,二氧化硫可与品红褪色,可与碱溶液反应,可完成实验,故A正确;
B.图中分液漏斗的下端未紧靠烧杯内壁,故B错误;
C.图中试管中的导管应长进短出,故C错误;
D.盐酸为无氧酸,且盐酸挥发,盐酸与硅酸钠反应,则不能比较Cl、C、Si的非金属性,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的性质、实验操作和技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列叙述正确的是( )
| A. | 原电池将电能转化为化学能 | B. | 电解池将化学能转化为电能 | ||
| C. | 原电池的负极失电子 | D. | 电解池的阳极发生还原反应 |
1.关于相同物质的量浓度的NaHCO3溶液和NaHSO3溶液,下列说法正确的是( )
| A. | 滴加酚酞后溶液均变红 | |
| B. | 滴加饱和澄清石灰水均产生白色沉淀 | |
| C. | 滴加氯水均产生能使澄清石灰水变浑浊的气体 | |
| D. | 所含阳离子的总浓度相等 |
13.下列有关FeBr2溶液的叙述错误的是(NA代表阿伏加德罗常数的数值)( )
| A. | 该溶液中Cu2+、NH4+、SO42-、Cl-可以大量共存 | |
| B. | 与硝酸酸化的AgNO3溶液反应有淡黄色沉淀生成并放出气体 | |
| C. | 向含有1 mol FeBr2的溶液中通入33.6 L Cl2,反应转移电子数目为3NA | |
| D. | 向该溶液中通入过量Cl2,反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
20.下列溶液中n(Cl-) 与50mL 1mol/L 氯化铝溶液中的n(Cl-) 相等的是( )
| A. | 150 mL 1mol/L 氯化钠溶液 | B. | 75 mL 2mol/L 氯化镁溶液 | ||
| C. | 150 mL 2mol/L氯化铵溶液 | D. | 50 mL 3mol/L 氯化铁溶液 |
10.下列与胶体无关的是( )
| A. | 丁达尔效应 | B. | 明矾的净水作用 | ||
| C. | CuSO4溶液显蓝色 | D. | 分散质粒子直径1~100nm |
14.设NA代表阿伏伽德罗常数,下列说法正确的是( )
| A. | 1molNO和CO2的混合气体所含的原子数目为2NA | |
| B. | 在常温常压下,32g氧气所含的原子数目为NA | |
| C. | 在常温常压下,11.2L氮气所含的分子数目为0.5NA | |
| D. | 17g氨气所含电子数目为10NA |
15.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果.下列表达不正确的是( )
| A. | 分散质粒子直径与分散系种类: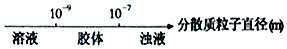 | |
| B. | NaOH溶液与CO2反应后溶液中的钠盐: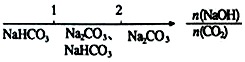 | |
| C. | AlCl3溶液中滴加NaOH溶液后铝的存在形式: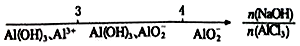 | |
| D. | Na与O2反应的产物: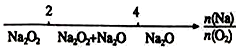 |