题目内容
用过量的H2SO4.NaOH.NH3?H2O.NaCl等溶液,按图所示步骤分开五种离子.则溶液①②③④是( )


| A、①NaCl ②NaOH ③NH3?H2O ④H2SO4 |
| B、①H2SO4 ②NaOH ③NH3?H2O ④NaCl |
| C、①H2SO4 ②NH3?H2O ③NaOH ④NaCl |
| D、①NaCl ②NH3?H2O ③NaOH ④H2SO4 |
考点:物质分离、提纯的实验方案设计
专题:
分析:根据题中信息可知:加入①时,只产生一种沉淀,故①一定是NaCl,沉淀为AgCl;在滤液中加入②后,生成两种沉淀,故②是NH3?H2O或NaOH而生成的沉淀,有一种在③中溶解,故②为NH3?H2O,③为NaOH,则④为H2SO4.
解答:
解:从题目所给的图示步骤综合分析可知,第①步分离五种离子中的一种离子,只能是Ag+与Cl-结合生成AgCl沉淀;
第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3?H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离;
第④步用SO42-将Ba2+和K+分离,
所以溶液①②③④分别为:NaCl、NH3?H2O、NaOH、H2SO4,
故选D.
第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3?H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离;
第④步用SO42-将Ba2+和K+分离,
所以溶液①②③④分别为:NaCl、NH3?H2O、NaOH、H2SO4,
故选D.
点评:本题考查了物质的分离、提纯实验方案的设计,题目难度中等,明确常见离子的性质为解答根据,注意根据物质的性质进行实验设计,试题充分考查了学生的分析、理解能力.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
一定温度下的密闭容器中发生可逆反应C(s)+H2O(g)?CO(g)+H2(g),一定能说明该反应已达到平衡状态的是( )
| A、v逆(H2O)=v正(CO) |
| B、容器中物质的总质量不发生变化 |
| C、n(H2O):n(H2)=1:1 |
| D、生成1molCO的同时生成1molH2 |
已知H-H键能为436KJ/mol,H-N键能为391KJ/mol,根据化学方程式N2+3H2=2NH3△H=-92.4KJ/mol,则N≡N键的键能是( )
| A、431 KJ/mol |
| B、946 KJ/mol |
| C、649 KJ/mol |
| D、869 KJ/mol |
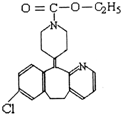 开瑞坦是治疗过敏性鼻炎的良药,其有效成分的结构简式如图所示,下列关于该有机物的说法正确的是( )
开瑞坦是治疗过敏性鼻炎的良药,其有效成分的结构简式如图所示,下列关于该有机物的说法正确的是( )| A、该有机物的分子式是C22H23N2O2Cl |
| B、分子中含有四个六元环,其中有一个是苯环 |
| C、1mol分子发生水解反应后能得到2mol新分子 |
| D、1mol分子发生加成反应需要8mol H2 |
某无色透明呈强碱性溶液中能大量共存的离子组是( )
| A、Na+ Cu2+ NO3- Cl- |
| B、K+ NO3- Na+Cl- |
| C、K+ CO32- NO3- Ca2+ |
| D、K+ NO3- SO42- Mg2+ |
炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸.下列说法不正确的是( )
| A、CN-可以和稀硫酸反应生成HCN |
| B、CN-可被Cl2氧化成(CN)2 |
| C、在水溶液中(CN)2可被F-还原 |
| D、HCN的结构式为 H-C≡N |
下列关于有机化合物的说法正确的是( )
| A、甲烷和乙烯都可以与氯气反应 |
| B、异丁烷与2-甲基丁烷互为同分异构体 |
| C、油脂和淀粉都是高分子化合物 |
| D、乙烯可以与氢气发生加成反应,苯不能与氢气加成 |