题目内容
 联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.(1)有效“减碳”的手段之一是节能.下列制氢方法最节能的是
A.电解水制氢:2H2O
| ||
B.高温使水分解制氢:2H2O
| ||
C.太阳光催化分解水制氢:2H2O
| ||
| 太阳光 |
D.天然气制氢:CH4+H2O
| 高温 |
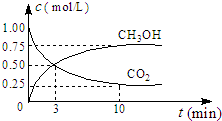
(2)CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①写出由CO2和H2制取甲醇的反应的平衡常数表达式
②从3min到10min,v(H2)=
③能说明上述反应达到平衡状态的是
A.反应中CO2和CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3molH2,同时生成1molH2O
D.CO2的体积分数在混合气体中保持不变
④下列措施能使
| n(CH3OH) |
| (CO2) |
A.升高温度 B.恒温恒容充入氦气 C.将水蒸气从体系中分离 D.恒温恒容再充入1mol CO2和3molH2
(3)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一.
2CO2(g)+6H2(g)→CH3OCH3(g)+3H2O(l).有人设想利用二甲醚制作燃料电池,以KOH溶液做电解质溶液,试写出该电池工作时负极反应的电极反应方程式
考点:物质的量或浓度随时间的变化曲线,化学电源新型电池,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)太阳能是取之不尽用之不竭的能源;
(2)①根据化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
②3min到10min,CO2浓度变化,计算CO2化学反应速率,利用计量数之比得到v(H2);
③根据化学平衡状态特征判断;
④为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量;
(3)电池负极应为二甲醚的氧化反应.
(2)①根据化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
②3min到10min,CO2浓度变化,计算CO2化学反应速率,利用计量数之比得到v(H2);
③根据化学平衡状态特征判断;
④为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量;
(3)电池负极应为二甲醚的氧化反应.
解答:
解:(1)(1)太阳光是取之不尽用之不竭的能源,故C最节能,故答案为:C;
(2)①根据化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,即化学平衡常数表达式为:K=
,
故答案为:K=
;
②3min到10min,CO2浓度变化为0.5mol/L-0.25mol/L=0.25mol/L,CO2反应速率为:
=
mol/(L?min),v(H2)=3×v(CO2)=
=0.11mol/(L?min),
故答案为:0.11;
③A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点),浓度相等而不是不变,故A错误;
B.ρ=
,反应前后,气体质量不变,容器体积不变,则气体密度始终不变,不能判断是否平衡,故B错误;
C.单位时间内每消耗3mol H2,同时生成1mol H2O,从反应开始到平衡始终相等,不一定平衡,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明正逆反应速率相等,达平衡状态,故D正确;
故答案为:D;
④使平衡向正反应移动,但不能只增大二氧化碳或降低甲醇的量,
A.正反应放热,升高温度平衡向逆反应方向移动,故A错误;
B.恒温恒容充入He反应物和生成物的浓度不变,对平衡无影响,故B错误;
C.将H2O(g)从体系中分离,减少生成物的浓度,平衡右移,故C正确;
D.恒温恒容再充入1mol CO2和3mol H2,相当于增大氢气的浓度,使平衡时CO2转化率增大,故D正确.
故答案为:CD;
(3)电池负极应为二甲醚的氧化反应,在碱性条件下生成CO32-,电极反应式为C2H6O+16OH--12e-═2CO32-+11H2O,
故答案为:C2H6O+16OH--12e-═2CO32-+11H2O.
(2)①根据化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,即化学平衡常数表达式为:K=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
故答案为:K=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
②3min到10min,CO2浓度变化为0.5mol/L-0.25mol/L=0.25mol/L,CO2反应速率为:
| 0.25mol/L |
| 10min-3min |
| 0.25 |
| 7 |
| 0.75 |
| 7 |
故答案为:0.11;
③A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点),浓度相等而不是不变,故A错误;
B.ρ=
| m |
| V |
C.单位时间内每消耗3mol H2,同时生成1mol H2O,从反应开始到平衡始终相等,不一定平衡,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明正逆反应速率相等,达平衡状态,故D正确;
故答案为:D;
④使平衡向正反应移动,但不能只增大二氧化碳或降低甲醇的量,
A.正反应放热,升高温度平衡向逆反应方向移动,故A错误;
B.恒温恒容充入He反应物和生成物的浓度不变,对平衡无影响,故B错误;
C.将H2O(g)从体系中分离,减少生成物的浓度,平衡右移,故C正确;
D.恒温恒容再充入1mol CO2和3mol H2,相当于增大氢气的浓度,使平衡时CO2转化率增大,故D正确.
故答案为:CD;
(3)电池负极应为二甲醚的氧化反应,在碱性条件下生成CO32-,电极反应式为C2H6O+16OH--12e-═2CO32-+11H2O,
故答案为:C2H6O+16OH--12e-═2CO32-+11H2O.
点评:本题考查化学平衡的有关计算,本题难度不大,做题时注意平衡常数的计算和应用.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
某有机物分子中含有n个-CH2-,m个 ,a个-CH3,其余为-Cl,则Cl的个数为( )
,a个-CH3,其余为-Cl,则Cl的个数为( )
 ,a个-CH3,其余为-Cl,则Cl的个数为( )
,a个-CH3,其余为-Cl,则Cl的个数为( )| A、2n+3m-a |
| B、m+2-a |
| C、n+m+a |
| D、m+2n+2-a |
下列有关实验装置或操作正确的是( )
A、 称量氢氧化钠固体 |
B、 分离苯、水混合物 |
C、 配制150mL 0.10mol?L-1盐酸 |
D、 分离沸点相差较大的互溶液体混合物 |
 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号或化学式表示):
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号或化学式表示): 如图表示一个电解池.X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液.
如图表示一个电解池.X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液. 和
和 ; ②
; ② 和
和 ;
;
