题目内容
9.Ⅰ.硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用,但硫的氧化物直接排放到大气中会造成污染.
(1)一种以铜作催化剂脱硫的工艺有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2nCu+(n+1)O2+(2-2n)H2O═2nCuSO4+(2-2n)H2SO4
该反应中的还原剂为Cu和SO2;每吸收标准状况下11.2LSO2,被SO2还原的O2的质量为8g.
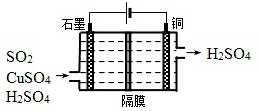
②利用如图所示电化学装置吸收另一部分SO2,并完成Cu的再生.写出装置内所发生反应的离子方程式:SO2+2H2O+Cu2+$\frac{\underline{\;电解\;}}{\;}$4H++SO42-+Cu
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
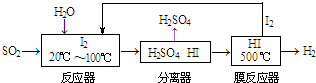
①用离子方程式表示反应器中发生的反应:SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
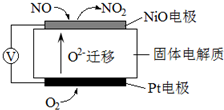
Ⅱ.汽车尾气是造成雾霾天气的重要原因之一.已知氮的氧化物是汽车尾气的污染物,用如图装置可监测其含量,电池中每转移0.4mol e-,Pt电极消耗2.24L氧气(标况下);该装置负极反应式为NO-2e-+O2-=NO2.
分析 I.(1)①2SO2+2nCu+(n+1)O2+(2-2n)H2O═2nCuSO4+(2-2n)H2SO4中,Cu、S元素的化合价升高,结合电子守恒计算;
②利用电解原理将二氧化硫转化成硫酸吸收,先写出两个电极上上发生的电极反应式,加和就可得到总的离子方程式;
(2)①反应器中二氧化硫、碘发生氧化还原反应生成硫酸和HI;
②HI分解反应为可逆反应;
Ⅱ.由离子的定向移动可知NiO极为原电池的负极,Pt极为原电池的正极,正极发生还原反应,负极发生氧化反应,以此解答该题.
解答 解:Ⅰ.(1)①2SO2+2nCu+(n+1)O2+(2-2n)H2O═2nCuSO4+(2-2n)H2SO4中,Cu、S元素的化合价升高,则Cu和SO2为还原剂,每吸收标准状况下11.2LSO2,其物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,由电子守恒可知,被SO2还原的O2的质量为$\frac{0.5mol×(6-4)}{2×(2-0)}$×32g/mol=8g,故答案为:Cu和SO2;8;
②分析图中电解装置,可知左边石墨是电解池的阳极,右边是阴极;阳极放电的物质二氧化硫,失去电子生成硫酸根离子,电极反应式:SO2-2e-+2H2O=SO42-+4H+;阴极放电的物质时铜离子,得到电子被还原成单质铜,电极反应式:Cu2++2e-=Cu;将上述两电极的电极反应式得总电池反应为SO2+2H2O+Cu2+$\frac{\underline{\;电解\;}}{\;}$4H++SO42-+Cu,
故答案为:SO2+2H2O+Cu2+$\frac{\underline{\;电解\;}}{\;}$4H++SO42-+Cu;
(2)①反应器中二氧化硫、碘发生氧化还原反应生成硫酸和HI,离子反应为SO2+I2+2H2O=SO42-+2I-+4H+,故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
②HI分解反应为可逆反应,则使用膜反应器分离出H2的目的是及时分离出产物H2,有利于反应正向进行,故答案为:HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
Ⅱ.由离子的定向移动可知NiO极为原电池的负极,负极反应为NO-2e-+O2-=NO2,pt电极上电极反应为O2+4e-=2O2-,则电池中每转移0.4mol e-,Pt电极消耗氧气为0.1mol×22.4L/mol=2.24L,故答案为:2.24;NO-2e-+O2-=NO2.
点评 本题考查氧化还原反应及电化学知识,为高考常见题型和高频考点,注意把握原电池的工作原理,本题解答的关键是离子的定向移动,以此可确定电源的两极和反应类型,注意体会答题思路,题目难度中等.

| A. | SO2、SiO2、NO2均为酸性氧化物 | |
| B. | 稀豆浆、鸡蛋清溶液、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、甲苯均为电解质 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将干燥纯净的氯气通入装有湿润的红色纸条的试剂瓶中 | 红色褪去 | 氯气有漂白性 |
| B | 往乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性KMnO4溶液中 | 酸性KMnO4溶液紫红色褪去 | 证明乙烯能被酸性高锰酸钾氧化 |
| C | 取少量BaSO4固体于试管中,加入足量的盐酸 | 沉淀不溶解 | BaSO4不溶于盐酸,且可以用盐酸和BaCl2溶液检验SO42- |
| D | 在分液漏斗中加入碘水后再加入苯,充分振荡 | 分层,且上层溶液呈紫色 | 苯可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
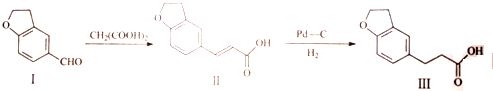
| A. | 可用浓溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| C. | 1mol化合物Ⅰ最多能与3molH2发生加成反应 | |
| D. | 与化合物Ⅰ互为同分异构体,且分子含有2个醛基的芳香族化合物有10种 |
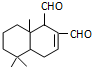
| A. | H2 | B. | Ag(NH3)2OH溶液 | C. | HBr | D. | Br2的CCl4溶液 |
| A. | X、Y均能燃烧,都有大量浓烟产生 | |
| B. | X既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应 | |
| C. | Y属于不饱和烃 | |
| D. | Y的二氯代物有三种 |
| A. | 利用蒸馏分离有机物时,明火尽量与接液器保持一定距离 | |
| B. | 做焰色反应实验时,铂丝需要在硫酸中蘸洗 | |
| C. | 实验室制取氨气时,收集装置必须洗净但无需干燥 | |
| D. | 甲烷与氧气反应时,需要黑纸遮挡避免灯光照射 |
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z<M | |
| C. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| D. | 等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z |

| A. | 图①常用于分离沸点相差较大的液体混合物 | |
| B. | 图②用于吸收尾气SO2 | |
| C. | 图③用于干燥、收集少量NH3 | |
| D. | 采用图④的操作排出碱式滴定管尖嘴处的气泡 |