题目内容
物质制备过程中离不开物质的提纯。以下除杂方法不正确的是
选项 | 目的 | 实验方法 |
A | 除去Na2CO3固体中的NaHCO3 | 置于坩埚中加热至恒重 |
B | 除去NaCl中少量KNO3 | 将混合物制成热饱和溶液,冷却结晶,过滤 |
C | 除去CO2中的HCl气体 | 通过NaHCO3(aq,饱和),然后干燥 |
D | 除去C2H5Br中的Br2 | 加入足量Na2SO3(aq),充分振荡,分液 |
B
【解析】
试题分析:A.NaHCO3不稳定,受热分解产生Na2CO3、CO2、H2O,CO2、H2O会逸出,因此最后得到的固体就是Na2CO3。故可以通过把混合物置于坩埚中加热至恒重的方法除杂,正确;B.KNO3的溶解度受温度的影响变化较大,而NaCl的溶解度受温度的影响变化较小,因此除去NaCl中少量KNO3,将混合物制成饱和溶液,然后升高温度,趁热过滤,就得到较纯净的NaCl晶体,错误;C.由于HCl的酸性比碳酸强,可以与NaHCO3反应产生CO2气体,而CO2与饱和NaHCO3不能反应,也不能溶解,因此可以达到除杂的目的,正确;D.Br2有强的氧化性,在溶液中与Na2SO3发生反应,产生HBr和Na2SO4,而溶于水,而C2H5Br不溶于水,然后充分振荡,分液就可以达到除杂的目的,正确。
考点:考查物质分离除杂的试剂的选择及方法的使用的正误判断的知识。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案(本题共10分)水煤气转化反应CO(g)+H2O(g)  CO2(g)+H2 (g)在一定温度下达到化学平衡。完成下列填空:
CO2(g)+H2 (g)在一定温度下达到化学平衡。完成下列填空:
29.写出该反应的平衡常数表达式K=________________。
30.一定温度下,在一个容积不变的密闭容器中发生上述反应,下列说法中能判断该反应达到化学平衡状态的是 (选填编号)。
A.容器中的压强不变
B.1 mol H―H键断裂的同时断裂2 molH―O键
C.v正(CO) = v逆(H2O)
D.c(CO) = c(H2)
31.将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下实验1和实验2的数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 3 |
2 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
3 | 950 | 1 | 2 | — | — | — |
(1)由实验组1的数据可知,平衡时CO的转化率为 %。
(2)由实验组1和2的数据可分析,压强对该可逆反应的影响是 。
(3)有了实验组1和2的数据,再设计实验3,其目的是 。

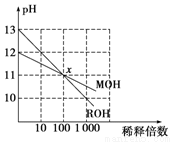
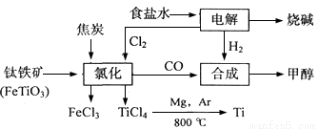
 2MgCl4+Ti在Ar气氛中进行的理由是 。
2MgCl4+Ti在Ar气氛中进行的理由是 。