题目内容
7.用惰性电极电解CuSO4溶液一段时间,停止后,向所得溶液中加入0.2molCu(OH)2,恰好使溶液恢复至电解前,关于电解过程说法不正确的是( )| A. | 生成的铜的物质的量是0.2mol | B. | 随着电解进行溶液的pH减小 | ||
| C. | 转移电子的物质的量为0.4mol | D. | 阳极反应是2H2O-4e-=4H++O2↑ |
分析 根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,Cu(OH)2从组成上可看成CuO•H2O,所以实际上相当于加入的物质是氧化铜和水,依据电极反应和电解的物质分析计算判断.
解答 解:加入0.2 mol Cu(OH)2后恰好恢复到电解前的浓度,Cu(OH)2从组成上可看成CuO•H2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,则阴极上析出氢气和铜,生成0.2mol铜转移电子个数=0.2mol×2×NA/mol=0.4NA,根据原子守恒知,生成0.2mol水需要0.2mol氢气,生成0.2mol氢气转移电子的个数=0.2mol×2×NA/mol=0.4NA,所以电解过程中共转移电子数为0.8NA,
A、分析可知生成铜的物质的量为0.2mol,故A正确;
B、电解过程中生成硫酸,所以随着电解的进行溶液pH减小,故B正确;
C、阴极上析出氢气和铜,生成0.2mol铜转移电子个数=0.2mol×2×NA/mol=0.4NA,根据原子守恒知,生成0.2mol水需要0.2mol氢气,生成0.2mol氢气转移电子的个数=0.2mol×2×NA/mol=0.4NA,所以电解过程中共转移电子数为0.8NA,故C错误;
D、阳极电极反应是氢氧根离子失电子生成氧气的过程,阳极反应式是4OH--4e-=2H2O+O2↑,故D正确;
故选C.
点评 本题考查了电解原理,明确阴极上析出的物质是解本题关键,根据生成物与转移电子之间的关系式来解答即可,难度中等.

练习册系列答案
相关题目
2.全世界每年因钢铁锈蚀造成大量的损失.某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如下实验.
请回答:
①在一周的观察过程中,他发现实验序号为II的试管中铁钉锈蚀速度最慢.
②下列防止钢铁锈蚀的措施不合理的是C(填字母).
A.在自行车的钢圈表面镀镍
B.改变金属内部结构制成不锈钢.
C.在地下钢铁管道上连接铜块
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:铁锅的腐蚀主要是由电化学腐蚀造成的.
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 内容 | 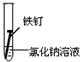 | 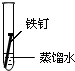 | 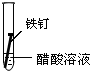 |
①在一周的观察过程中,他发现实验序号为II的试管中铁钉锈蚀速度最慢.
②下列防止钢铁锈蚀的措施不合理的是C(填字母).
A.在自行车的钢圈表面镀镍
B.改变金属内部结构制成不锈钢.
C.在地下钢铁管道上连接铜块
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:铁锅的腐蚀主要是由电化学腐蚀造成的.
15.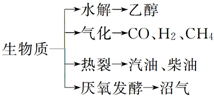 “地沟油”被称为“生物燃料”,该燃料属于生物质能.已知生物质的主要转化途径及主要产物如图所示.则下列关于生物燃料以及生物质能的说法中正确的是( )
“地沟油”被称为“生物燃料”,该燃料属于生物质能.已知生物质的主要转化途径及主要产物如图所示.则下列关于生物燃料以及生物质能的说法中正确的是( )
①生物燃料本质上能量来源于太阳能
②由纤维素水解获得的乙醇属于生物质能
③生物质裂解获得的汽油、柴油等属于纯净物
④由植物秸秆等发酵获得的沼气,主要成分是甲烷
⑤生物质资源是一种污染小的可再生能源.
 “地沟油”被称为“生物燃料”,该燃料属于生物质能.已知生物质的主要转化途径及主要产物如图所示.则下列关于生物燃料以及生物质能的说法中正确的是( )
“地沟油”被称为“生物燃料”,该燃料属于生物质能.已知生物质的主要转化途径及主要产物如图所示.则下列关于生物燃料以及生物质能的说法中正确的是( )①生物燃料本质上能量来源于太阳能
②由纤维素水解获得的乙醇属于生物质能
③生物质裂解获得的汽油、柴油等属于纯净物
④由植物秸秆等发酵获得的沼气,主要成分是甲烷
⑤生物质资源是一种污染小的可再生能源.
| A. | ①②③④⑤ | B. | ①②④⑤ | C. | ③④⑤ | D. | ①②③④ |
19.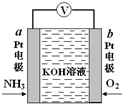 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )| A. | 溶液中OH-向电极a移动 | |
| B. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| C. | O2在电极b上发生还原反应 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-=N2↑+6H2O |
16. 某恒密闭容器中,一定量的X与Y发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述中正确的是( )
某恒密闭容器中,一定量的X与Y发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述中正确的是( )
 某恒密闭容器中,一定量的X与Y发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述中正确的是( )
某恒密闭容器中,一定量的X与Y发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述中正确的是( )| A. | 反应温度T1>T2该反应是吸热反应 | |
| B. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| C. | M点的平衡常数比W点的平衡常数小 | |
| D. | M点时再加入一定量的X,平衡后X的转化率增大 |
17.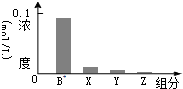 室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
 室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A. | 溶液显中性 | B. | 升温,c(X)增大,c(Y)减小 | ||
| C. | c(B+)+c(Y)=c(Cl-) | D. | 稀释溶液,c(X)增大,c(Z)增大 |
 氨是重要的化工原料,用途很广.
氨是重要的化工原料,用途很广.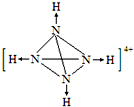 .
.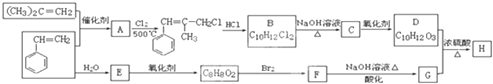
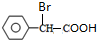 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$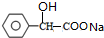 +NaBr+H2O.
+NaBr+H2O.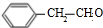 .
.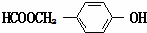 (写结构简式).
(写结构简式).