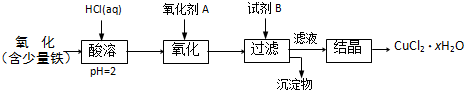
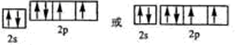题目内容
已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:
(1)写出①②和③步所有反应的化学方程式:
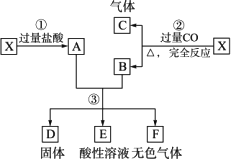
________;________.________;________.________;________.
(2)设从③步所得固体D的质量为32 g,溶液E中只含有一种金属离子,气体F在标准状况下的体积为5.6 L,试计算取用的每份X的质量和X中FeO与CuO的质量比.
答案:
解析:
解析:
|
答案:(1)①FeO+2HCl ②FeO+CO ③CuCl2+Fe (2)56 g 9∶5 解析:X溶于过量的HCl,故A为FeCl2、CuCl2、HCl的混合溶液.X与过量的CO反应,固体产物为Fe和Cu,气体为CO2,而B能与A反应,故B为Fe和Cu的混合物.B与A反应的溶液呈酸性,说明HCl还有余,故固体D中只有Cu,而气体F为H2,E为FeCl2和HCl的混合溶液.显然,固体D的质量为32 g,来自于两份X,每份X中的m(CuO)=(32 g/2/64 g·mol-1)×80 g·mol-1=20 g.B中的铁与A溶液发生了两个反应,即置换出H2和Cu,m(FeO)=(5.6 L/22.4 L·mol-1+20 g/80 g·mol-1)×72 g·mol-1=36 g,所以,m(FeO)/m(CuO)=36/20=9∶5.每份X的质量为20 g+36 g=56 g. |

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
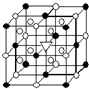 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子