题目内容
(Ⅰ)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大.W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物.
(1)W位于元素周期表第
W的气态氢化物稳定性比H2O(g)
(2)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
(3)Fe(s)+
O2(g)=FeO(s)△H+-272.0KJ?mol-1
2X(s)+
O2(g)=x2o3(s)△H=-1675.7KJ?mol-1
X的单质和FeO反应的热化学方程式是
(Ⅱ)已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为
(2)Y元素原子的价层电子的轨道表示式为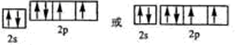
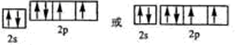 _
_
(3)X与Z可形成化合物XZ3,该化合物的空间构型为
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
(1)W位于元素周期表第
二
二
周期第ⅤA
ⅤA
族.W的气态氢化物稳定性比H2O(g)
弱
弱
(填“强”或“弱”).(2)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O
| ||
2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O
.
| ||
(3)Fe(s)+
| 1 |
| 2 |
2X(s)+
| 3 |
| 2 |
X的单质和FeO反应的热化学方程式是
Al(S)+FeO(S)+
O2 (g)=
Al2O3(S)+Fe(S)△H=-565.85KJ/mol
| 1 |
| 4 |
| 1 |
| 2 |
Al(S)+FeO(S)+
O2 (g)=
Al2O3(S)+Fe(S)△H=-565.85KJ/mol
.| 1 |
| 4 |
| 1 |
| 2 |
(Ⅱ)已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为
1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p3
(2)Y元素原子的价层电子的轨道表示式为
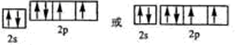
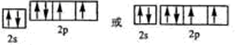
(3)X与Z可形成化合物XZ3,该化合物的空间构型为
三角锥形
三角锥形
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
.分析:(Ⅰ)导致酸雨的主要物质是二氧化氮和二氧化硫,且W、X、Y、Z是周期表前36号元素中的四种常见元素,Y的原子序数大于W的,所以W是氮元素,Y是硫元素;X的基态原子核外有7个原子轨道填充了电子,且原子序数大于W小于Y,所以X是铝元素;Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,且Z是前36号元素,Z的原子序数大于Y的,所以Z是铜元素;
(1)根据其原子结构示意图判断其在元素周期表中的位置;
(2)Y的最高价氧化物对应水化物的浓溶液是浓硫酸,浓硫酸能与Z的单质铜发生氧化还原反应;
(3)将方程式
×②-①得方程式即为X的单质和FeO反应的热化学方程式;
(Ⅱ)X元素原子的4p轨道上有3个未成对电子,则X是砷元素,Y元素原子的最外层2p轨道上有2个未成对电子,则Y共有2个电子层,Y是碳或氧元素,X跟Y可形成化合物X2Y3,所以Y是氧元素;Z元素可以形成负一价离子,所以Z属于第ⅤⅡA元素,且X、Y和Z三种元素的原子序数之和等于42,所以Z是氢元素;
(1)根据基态原子核外电子排布式书写规则书写其电子排布式;
(2)氧元素的价层电子就是其最外层电子,根据其书写规则书写;
(3)同一主族元素,形成的化合物结构具有相似性,根据氨气分子的空间构型判断XZ3的空间构型;
(4)根据元素守恒和得失电子守恒写出反应方程式.
(1)根据其原子结构示意图判断其在元素周期表中的位置;
(2)Y的最高价氧化物对应水化物的浓溶液是浓硫酸,浓硫酸能与Z的单质铜发生氧化还原反应;
(3)将方程式
| 1 |
| 2 |
(Ⅱ)X元素原子的4p轨道上有3个未成对电子,则X是砷元素,Y元素原子的最外层2p轨道上有2个未成对电子,则Y共有2个电子层,Y是碳或氧元素,X跟Y可形成化合物X2Y3,所以Y是氧元素;Z元素可以形成负一价离子,所以Z属于第ⅤⅡA元素,且X、Y和Z三种元素的原子序数之和等于42,所以Z是氢元素;
(1)根据基态原子核外电子排布式书写规则书写其电子排布式;
(2)氧元素的价层电子就是其最外层电子,根据其书写规则书写;
(3)同一主族元素,形成的化合物结构具有相似性,根据氨气分子的空间构型判断XZ3的空间构型;
(4)根据元素守恒和得失电子守恒写出反应方程式.
解答:解:(Ⅰ)导致酸雨的主要物质是二氧化氮和二氧化硫,且W、X、Y、Z是周期表前36号元素中的四种常见元素,Y的原子序数大于W的,所以W是氮元素,Y是硫元素;X的基态原子核外有7个原子轨道填充了电子,且原子序数大于W小于Y,所以X是铝元素;Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,且Z是前36号元素,Z的原子序数大于Y的,所以Z是铜元素.
(1)W是N元素,N原子的原子结构示意图为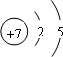 ,电子层数等于其周期数,最外层电子数等于其主族序数,所以氮元素属于第二周期第ⅤA族;
,电子层数等于其周期数,最外层电子数等于其主族序数,所以氮元素属于第二周期第ⅤA族;
气态氢化物的稳定性与元素的非金属性有关系,非金属越强,气态氢化物的稳定性越强,氧元素的非金属性大于氮元素的非金属性,所以水的稳定性大于氨气的稳定性,
故答案为:二;ⅤA;弱;
(2)浓硫酸和铜在加热条件下能反应生成硫酸铜、水和二氧化硫,反应方程式为:2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O,
故答案为:2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O;
(3)Fe(s)+
O2(g)=FeO(s)△H=-272.0KJ?mol-1 ①
2X(s)+
O2(g)=x2o3(s)△H=-1675.7KJ?mol-1 ②
将方程式
×②-①得方程式X的单质和FeO反应的热化学方程式是:As(S)+FeO(S)+
O2 (g)=
As2O3(S)+Fe(S)△H=-565.85KJ/mol,
故答案为:Al(S)+FeO(S)+
O2 (g)=
Al2O3(S)+Fe(S)△H=-565.85KJ/mol;
(Ⅱ)X元素原子的4p轨道上有3个未成对电子,则X是砷元素,Y元素原子的最外层2p轨道上有2个未成对电子,则Y共有2个电子层,Y是碳或氧元素,X跟Y可形成化合物X2Y3,所以Y是氧元素;Z元素可以形成负一价离子,所以Z属于第ⅤⅡA元素,且X、Y和Z三种元素的原子序数之和等于42,所以Z是氢元素.
(1)As元素原子基态时的电子排布式为1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;
(2)O元素原子的价层电子的轨道表示式为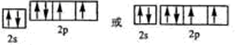 ,故答案为:
,故答案为: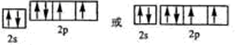 ;
;
(3)同一主族元素,形成的化合物结构具有相似性,氨气和砷化氢的结构相似,空间构型都是三角锥形,故答案为:三角锥形;
(4)化合物As2O3在稀硫酸溶液中可被金属锌还原为AsH3,产物还有ZnSO4和H2O,所以反应方程式为:As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O,
故答案为As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O.
(1)W是N元素,N原子的原子结构示意图为
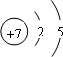 ,电子层数等于其周期数,最外层电子数等于其主族序数,所以氮元素属于第二周期第ⅤA族;
,电子层数等于其周期数,最外层电子数等于其主族序数,所以氮元素属于第二周期第ⅤA族;气态氢化物的稳定性与元素的非金属性有关系,非金属越强,气态氢化物的稳定性越强,氧元素的非金属性大于氮元素的非金属性,所以水的稳定性大于氨气的稳定性,
故答案为:二;ⅤA;弱;
(2)浓硫酸和铜在加热条件下能反应生成硫酸铜、水和二氧化硫,反应方程式为:2H2SO4(浓)+Cu
| ||
故答案为:2H2SO4(浓)+Cu
| ||
(3)Fe(s)+
| 1 |
| 2 |
2X(s)+
| 3 |
| 2 |
将方程式
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
故答案为:Al(S)+FeO(S)+
| 1 |
| 4 |
| 1 |
| 2 |
(Ⅱ)X元素原子的4p轨道上有3个未成对电子,则X是砷元素,Y元素原子的最外层2p轨道上有2个未成对电子,则Y共有2个电子层,Y是碳或氧元素,X跟Y可形成化合物X2Y3,所以Y是氧元素;Z元素可以形成负一价离子,所以Z属于第ⅤⅡA元素,且X、Y和Z三种元素的原子序数之和等于42,所以Z是氢元素.
(1)As元素原子基态时的电子排布式为1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;
(2)O元素原子的价层电子的轨道表示式为
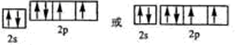 ,故答案为:
,故答案为: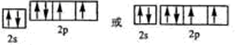 ;
;(3)同一主族元素,形成的化合物结构具有相似性,氨气和砷化氢的结构相似,空间构型都是三角锥形,故答案为:三角锥形;
(4)化合物As2O3在稀硫酸溶液中可被金属锌还原为AsH3,产物还有ZnSO4和H2O,所以反应方程式为:As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O,
故答案为As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O.
点评:本题考查了元素的推断、化学反应方程式、热化学反应方程式、核外电子排布式等知识点,难度不,能正确判断各元素是解本题的关键,注意书写基态原子核外电子排布式要遵循构造原理.

练习册系列答案
相关题目
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)