题目内容
已知:向![]() 离子溶液中加氨水,生成
离子溶液中加氨水,生成![]() 白色沉淀;当氨水过量时,
白色沉淀;当氨水过量时,![]() 沉淀又溶解,生成了
沉淀又溶解,生成了![]() .此外,
.此外,![]() 既可溶于盐酸生成
既可溶于盐酸生成![]() ,也可以溶于过量的
,也可以溶于过量的![]() 溶液,生成
溶液,生成![]() ,所以,
,所以,![]() 是一种两性氢氧化物.
是一种两性氢氧化物.
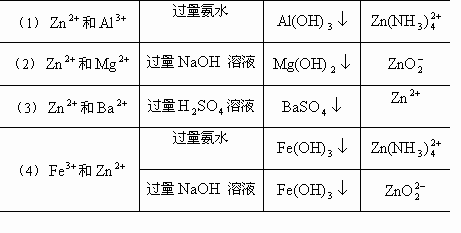
现有4组离子,每组有2种离子,请各选用一种试剂,将它们两者分开,可供选择的试剂有:A.硫酸B.盐酸C.硝酸D.氢氧化钠溶液E.氨水.请填写下表:
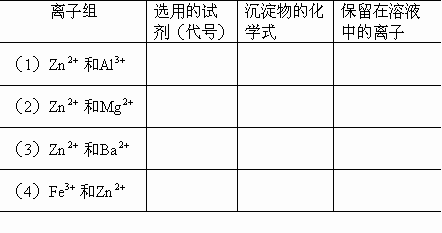
答案:
解析:
解析:
|
本题是一道信息给予式的试题.对于信息给予题,首要的是要理解试题给出的信息,本题题干中给出的信息有两点,一点是
另一点是
也就是说 (1)分离 (2)分离 (3)分离 (4)分离 解答
|

练习册系列答案
相关题目