题目内容
铁盐、亚铁盐是实验室常用的药品.根据题意完成下列填空:(1)若向硫酸亚铁溶液中滴加稀硝酸,可以看到溶液逐渐变黄.为检验最后溶液中是否还有亚铁离子剩余,可以
(2)向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生.呈红色的物质是
已知:11H2O2+2SCN-→2SO42-+2CO2↑+N2↑+10H2O+2H+
若生成1mol N2,H2O2和SCN-的反应中转移电子物质的量是
(3)由以上实验,推断Fe2+、S2-和SCN-的还原性强弱
(4)向FeCl3溶液中加入KOH溶液至过量,微热,再通入Cl2,可观察到溶液呈紫色(高铁酸钾:K2FeO4).写出此过程的离子方程式、配平并标出电子转移的数目和方向
分析:(1)在有铁离子存在的溶液检验溶液中是否还有亚铁离子,根据亚铁离子的还原性,加酸性高锰酸钾;铁离子和硫离子发生氧化还原反应;
(2)溶液变红是因为亚铁离子被氧化为铁离子,铁离子与硫氰根离子形成络合物,SCN-中的硫-2价→+6价,C的化合价未变,氮-3价→0价,升高(6+2)×2+3×2=22;
(3)由(1)知还原性S2->Fe2+,又因为向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生,首先反应的量亚铁离子,然后才氧化硫氰根离子,故还原性Fe2+>SCN-;
(4)氯气的强氧化性将铁离子氧化为正六价的K2FeO4,氢氧化铁是还原剂,氯气是氧化剂,1mol氢氧化铁失去3mole-.
(2)溶液变红是因为亚铁离子被氧化为铁离子,铁离子与硫氰根离子形成络合物,SCN-中的硫-2价→+6价,C的化合价未变,氮-3价→0价,升高(6+2)×2+3×2=22;
(3)由(1)知还原性S2->Fe2+,又因为向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生,首先反应的量亚铁离子,然后才氧化硫氰根离子,故还原性Fe2+>SCN-;
(4)氯气的强氧化性将铁离子氧化为正六价的K2FeO4,氢氧化铁是还原剂,氯气是氧化剂,1mol氢氧化铁失去3mole-.
解答:解:(1)在有铁离子存在的溶液检验溶液中是否还有亚铁离子,根据亚铁离子的还原性,加酸性高锰酸钾,具体操作为:取样,在样品中滴加酸性高锰酸钾溶液,若紫色褪去,则说明亚铁离子有剩余;铁离子和硫离子发生氧化还原反应,方程式为2Fe3++S2-═2Fe2++S↓,
故答案为:取样,在样品中滴加酸性高锰酸钾溶液,若紫色褪去,则说明亚铁离子有剩余;2Fe3++S2-═2Fe2++S↓;
(2)溶液变红是因为亚铁离子被氧化为铁离子,铁离子与硫氰根离子形成络合物Fe(SCN)3,SCN-中的硫-2价→+6价,C的化合价未变,氮-3价→0价,升高(6+2)×2+3×2=22,所以生成1mol氮气,转移电子物质的量是22mol,故答案为:Fe(SCN)3;22;
(3)由(1)知还原性S2->Fe2+,又因为向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生,首先反应的量亚铁离子,然后才氧化硫氰根离子,故还原性Fe2+>SCN-,综上所述还原性强弱顺序为:S2->Fe2+>SCN-,故答案为:S2->Fe2+>SCN-;
(4)氯气的强氧化性将铁离子氧化为正六价的K2FeO4,氢氧化铁是还原剂,氯气是氧化剂,1mol氢氧化铁失去3mole-,配平并标出电子转移的数目和方向为 ,故答案为:
,故答案为: .
.
故答案为:取样,在样品中滴加酸性高锰酸钾溶液,若紫色褪去,则说明亚铁离子有剩余;2Fe3++S2-═2Fe2++S↓;
(2)溶液变红是因为亚铁离子被氧化为铁离子,铁离子与硫氰根离子形成络合物Fe(SCN)3,SCN-中的硫-2价→+6价,C的化合价未变,氮-3价→0价,升高(6+2)×2+3×2=22,所以生成1mol氮气,转移电子物质的量是22mol,故答案为:Fe(SCN)3;22;
(3)由(1)知还原性S2->Fe2+,又因为向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生,首先反应的量亚铁离子,然后才氧化硫氰根离子,故还原性Fe2+>SCN-,综上所述还原性强弱顺序为:S2->Fe2+>SCN-,故答案为:S2->Fe2+>SCN-;
(4)氯气的强氧化性将铁离子氧化为正六价的K2FeO4,氢氧化铁是还原剂,氯气是氧化剂,1mol氢氧化铁失去3mole-,配平并标出电子转移的数目和方向为
 ,故答案为:
,故答案为: .
.点评:本题考查铁及化合物的性质,亚铁离子的检验、微粒还原性的强弱和氧化还反应中电子转移数目和方向,难度适中.

练习册系列答案
相关题目
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀。两极材料分别为铁和石墨。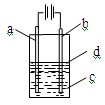
(1)a电极材料应为 ,电极反应式为 。
(2)电解液c最好是 (填编号)。
| A.纯水 | B.AgNO3溶液 | C.NaOH溶液 | D.CuCl2溶液 |
对c应作何简单处理? 。

 Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是
Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是