题目内容
2.工业上用黄铜矿冶炼铜及对炉渣综合利用的一种工艺流程如下:
(1)冶炼过程中得到Cu2O和Cu的混合物称为“泡铜”,其中的Cu2O与金属A1在高温条件下反应可得粗铜,反应化学方程式为3Cu2O+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+6Cu. 粗铜精炼时应将粗铜连接在直流电源的正极.
(2)传统炼铜的方法主要是火法炼铜,其主要反应为:
①2CuFeS2+4O2 $\frac{\underline{\;高温\;}}{\;}$Cu2S+3SO2+2FeO
②2Cu2S+3O2 $\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2
③2Cu2O+Cu2S $\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑
反应③中的氧化剂是Cu2O和Cu2S,以上总反应可写为:2CuFeS2+5O2$\frac{\underline{\;高温\;}}{\;}$2FeO+4SO2+2Cu.
(3)炼铜产生的炉渣(含Fe2O3,FeO,SiO2,Al2O3)可制备Fe2O3.根据流程回答下列问题:
①加入适量NaClO溶液的目的是2Fe2++ClO-+2H+=2Fe3++Cl-+H2O (用离子方程式表示).
②除去Al3+的离子方程式是Al3++4OH-=AlO2-+2H2O.
③选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂有:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水.所选试剂是稀硫酸、KMnO4溶液.
实验设计:用稀硫酸溶解炉渣,取溶液向其中滴加高锰酸钾溶液,如果紫色褪去,证明含有Fe2+离子,证明炉渣中含有FeO.
分析 (1)Cu2O与金属A1在高温条件下反应得到Cu与氧化铝,电解精炼铜时,粗铜作阳极,连接直流电源的正极;
(2)所含元素化合价降低的反应物是氧化剂;总反应方程式中应消去中间产物:Cu2S、Cu2O,则CuFeS2与O2 在高温下反应生成Cu、SO2、FeO,配平书写方程式;
(3)炉渣含Fe2O3、FeO、SiO2、Al2O3,用过量盐酸溶解,发生反应:Fe2O3+6H+═2Fe3++3H2O、FeO+2H+═Fe2++H2O、Al2O3+6H+═2Al3++3H2O,SiO2不反应,过滤除去SiO2,所得滤液中含有FeCl3、FeCl2、AlCl3及过量的HCl,加入适量NaClO将Fe2+氧化为Fe3+,再加入足量NaOH溶液,使Fe3+转化为Fe(OH)3沉淀,使Al3+转化为AlO2-,再过滤除去AlO2-,沉淀洗涤、干燥,再煅烧得到Fe2O3,
①加入适量NaClO溶液的目的是将Fe2+氧化为Fe3+,自身被还原为Cl-,酸性条件下,同时有水生成;
②Al3+与过量的氢氧化钠反应转化为AlO2-;
③用酸溶解FeO,Fe2+具有还原性,再用KMnO4溶液检验Fe2+,注意不能用盐酸,由于KMnO4溶液可以氧化HCl.
解答 解:(1)Cu2O与金属A1在高温条件下反应得到Cu与氧化铝,反应方程式为:3Cu2O+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+6Cu,电解精炼铜时,粗铜作阳极,连接直流电源的正极,
故答案为:3Cu2O+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+6Cu;正;
(2)反应③2Cu2O+Cu2S $\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑中,化合价降低的Cu元素所在的反应物Cu2O和Cu2S是氧化剂;
总反应方程式中应消去中间产物:Cu2S、Cu2O,则CuFeS2与O2 在高温下反应生成Cu、SO2、FeO,总反应方程式为:2CuFeS2+5O2$\frac{\underline{\;高温\;}}{\;}$2FeO+4SO2+2Cu,
故答案为:Cu2O和Cu2S;2CuFeS2+5O2$\frac{\underline{\;高温\;}}{\;}$2FeO+4SO2+2Cu;
(3)炉渣含Fe2O3、FeO、SiO2、Al2O3,用过量盐酸溶解,发生反应:Fe2O3+6H+═2Fe3++3H2O、FeO+2H+═Fe2++H2O、Al2O3+6H+═2Al3++3H2O,SiO2不反应,过滤除去SiO2,所得滤液中含有FeCl3、FeCl2、AlCl3及过量的HCl,加入适量NaClO将Fe2+氧化为Fe3+,再加入足量NaOH溶液,使Fe3+转化为Fe(OH)3沉淀,使Al3+转化为AlO2-,再过滤除去AlO2-,沉淀洗涤、干燥,再煅烧得到Fe2O3,
①加入适量NaClO溶液的目的是将Fe2+氧化为Fe3+,自身被还原为Cl-,酸性条件下,同时有水生成,反应离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,故答案为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
②Al3+与过量的氢氧化钠反应转化为AlO2-,除去Al3+的离子方程式是Al3++4OH-=AlO2-+2H2O,
故答案为:Al3++4OH-=AlO2-+2H2O;
③由于KMnO4溶液可以氧化HCl,用稀硫酸溶解炉渣,取溶液向其中滴加高锰酸钾溶液,如果紫色褪去,证明含有Fe2+离子,证明炉渣中含有FeO,
故答案为:稀硫酸、KMnO4溶液;用稀硫酸溶解炉渣,取溶液向其中滴加高锰酸钾溶液,如果紫色褪去,证明含有Fe2+离子,证明炉渣中含有FeO.
点评 本题考查物质制备实验方案设计、物质的分离和提纯、物质检验、对操作的分析评价、氧化还原反应等,综合考察学生分析解决问题的能力、知识迁移运用能力,难度中等.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
(1)钇石矿(Y2FeBe2Si2O10)的组成用氧化物的形式表示为Y2O3•FeO•2BeO•2SiO2
(2)欲从Na2SiO3和Na2BeO2的混合液中制得Be(OH)2沉淀.则
①最好选用盐酸、b(填字母)两种试剂,再经过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2气体 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:BeO22-+4H+=Be2++2H2O
(3)上述过程中用氨水调节pH=a的目的是使Fe3+完全水解形成沉淀而除去,a应控制在3.7~6.0范围内;写出生成沉淀物A的离子方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,检验该过程是否沉淀完全的操作方法是取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀.
(4)写出由草酸钇沉淀制备氧化钇的化学方程式Y2(C2O4)3$\frac{\underline{\;高温\;}}{\;}$Y2O3+3CO↑+3CO2↑.
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙酸的结构式:CH3COOH | ||
| C. | 2-丁烯的键线式: | D. | 乙醇分子的比例模型: |
 下列叙述中正确的是( )
下列叙述中正确的是( )| A. | 该分子中所有原子共面 | |
| B. | 该分子可与FeCl3溶液反应呈紫色 | |
| C. | 1mol该物质最多可与4molH2发生反应 | |
| D. | 1mol该分子最多可与4mol溴发生反应 |
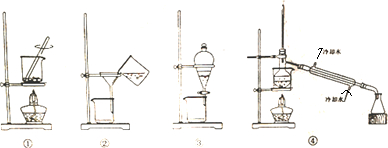
| A. | 装置①将海带灼烧成灰 | B. | 装置②过滤含I-的溶液 | ||
| C. | 装置③放出碘的CCl4溶液 | D. | 装置④分离碘并回收CCl4 |
| A. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应 | |
| B. | CH2=CHCH3+Br2$\stackrel{光照}{→}$CH2=CHCH2Br+HBr;加成反应 | |
| C. | 2CH3CH2OH+O2→2CH3CHO+2H2O;氧化反应 | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ +HBr;取代反应 +HBr;取代反应 |
 如图是实验室用乙醇与浓硫酸共热制乙烯的实验装置
如图是实验室用乙醇与浓硫酸共热制乙烯的实验装置 .
.