题目内容
6.在固定容积的密闭容器中,可逆反应2X(g)+2Y(s)?3Z(g),达到平衡后,若将容器中X、Y、Z的物质的量均减少一半,对该反应产生的影响是( )| A. | 正、逆反应速率都减小,平衡不移动 | |
| B. | 正、逆反应速率都减小,平衡向正反应方向移动 | |
| C. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
分析 在固定容积的密闭容器中,可逆反应2X(g)+2Y(s)?3Z(g),达到平衡后,若将容器中X、Y、Z的物质的量均减少一半,即先完全等效于将体积减小到原来的一半,再增大体积,相当于压强减小,则正、逆反应速率都减小,平衡向气体体积增大的方向移动,据此分析解答.
解答 解:固定容积的密闭容器中,可逆反应2X(g)+2Y(s)?3Z(g),达到平衡后,若将容器中X、Y、Z的物质的量均减少一半,即先完全等效于将体积减小到原来的一半,再增大体积,相当于压强减小,则正、逆反应速率都减小,平衡向气体体积增大的方向移动,即正反应方向移动,所以B正确;
故选:B.
点评 本题考查了等效平衡的应用,主要涉及反应速率的变化判断以及平衡移动方向的判断,难度不大,抓住成比例改变组成,可以采用先成比例的改变体积再恢复的方法判断.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
16.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 原子得电子能力强弱:W<X<Y<Z | |
| D. | T元素的单质可能具有半导体的特性,T与Z元素可形成化合物TZ4 |
17.25℃时,关于①O.l mol.L-1的NH4Cl溶液②0.1mol.L-1的NaOH溶液,下列叙述正确的是( )
| A. | 若向①中加适量水,溶液中$\frac{c(C{l}^{-})}{c(N{H}_{4}^{+})}$的值减小 | |
| B. | 若向②中加适量水,水的电离平衡正向移动 | |
| C. | 若将①和②均稀释100倍,①的pH变化更大 | |
| D. | 若将①和②混合,所得溶液的pH=7,则溶液中的c(NH3.H2O)>c(Na+) |
14.NA为阿伏伽德罗常数,下列叙述正确的是(相对原子质量:H-1O-16Mg-24)( )
| A. | 9gH2O中含有NA个电子 | |
| B. | 标准状况下,22.4L乙醇中含有2NA个碳原子 | |
| C. | 25℃,0.2mol•L-1CH3COONa溶液含有0.2NA个CH3COO- | |
| D. | 2.4g镁在空气中充分燃烧生成MgO和Mg3N2,转移0.2NA个电子 |
1.a-5X、b-3Y、aZ、bW、a+4T均为短周期元素,其原子半径随原子序数变化如图所示.Z是地壳中含量最高的金属元素,W原子最外层电子数是K层电子数的2倍.则下列说法正确的是( )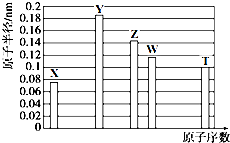

| A. | Z、T两种元素的离子半径相比,前者较大 | |
| B. | X、Y形成的两种化合物中,阴、阳离子物质的量之比分别为1:1和1:2 | |
| C. | X、W、T三种元素的气态氢化物中,稳定性最差的是W的氢化物,沸点最高的是T的氢化物 | |
| D. | Y、T两种元素的最高价氧化物对应的水化物均能溶解X和Z形成的常见化合物 |
11.能正确表示下列反应的离子方程式是( )
| A. | Ba(OH)2溶液中加入少量的NaHSO4溶液中:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| B. | SO2通入NaCO溶液中:SO2+ClO-+2OH-=SO42-+Cl-+H2O | |
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-=Fe(OH)2↓ | |
| D. | 用H2O2从酸化的海带灰浸出液中提取I2:H2O2+2I-=I2+2OH- |
18.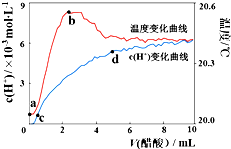 室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
 室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a~b段,醋酸电离过程为放热过程 | |
| B. | c~d段,c(H+)增加,醋酸电离度增加 | |
| C. | c点时,加入等体积等浓度的NaOH溶液则:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | d点时,c(H+)>c(CH3COOH) |
15. 铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
(1)铝离子的结构示意图为 .
.
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)氢氧化铝是医用的胃酸中和剂的一种.用离子方程式表示其作用机理是Al(OH)3+3H+=Al3++3H2O.
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是B (填字母序号).
(6)钢铁的析氢腐蚀简单示意图如图所示,正极的电极反应式为2H++2e-=H2↑.该图某处稍作修改即可成为钢铁电化学防护的简单示意图,其中一种方法是将C换成Zn等比Fe活泼的金属,请完善另一种方法的示意图.
 铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:(1)铝离子的结构示意图为
 .
.(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)氢氧化铝是医用的胃酸中和剂的一种.用离子方程式表示其作用机理是Al(OH)3+3H+=Al3++3H2O.
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是B (填字母序号).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | Ⅰ对;Ⅱ对. |
| C | 铁比铝更易锈蚀 | 铝比铁活泼 | Ⅰ错;Ⅱ对. |
| D | 铝在空气中表面生成致密氧化膜 | 可用铝罐储存运输浓硫酸、浓硝酸 | Ⅰ错;Ⅱ对. |
17.向AgCl浊液中滴加氨水后可得澄清溶液,继续滴加浓硝酸又有沉淀生成,经查资料得知:Ag++2NH3•H2O?[Ag(NH3)2]++2H2O,下列分析不正确的是( )
| A. | 实验表面实验室可用氨水洗涤银镜反应后的试管 | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) | |
| D. | 由资料信息科推知:加浓硝酸后生成的沉淀为AgCl |