题目内容
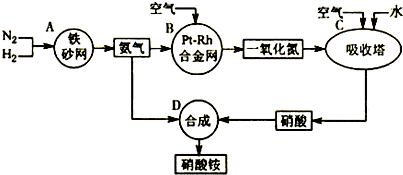
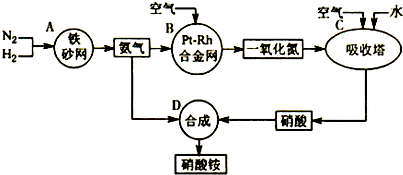
如图是工业生产硝酸的流程.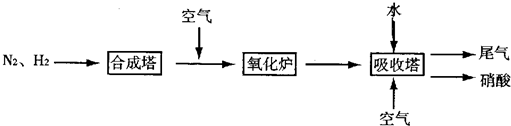
合成塔中内置铁触媒,氧化炉中内置Pt-Rh合金.请回答下列问题:
(1)1909年化学家哈伯在实验室首次合成了氨.2007年格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:

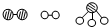 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别为
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别为(2)已知N≡N的键能是946kJ?mol-1,H-H的键能为436kJ?mol-1,N-H的键能为393kJ?mol-1,写出合成塔中发生反应的热化学方程式
(3)已知4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ?mol-1;
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ?mol-1;
则热化学方程式N2(g)+O2(g)═2NO(g)△H=
(4)吸收塔中通入空气的目的是
分析:(1)要结合题目给出的信息进行分析,物质要在催化剂的表面完成分子的中旧键断裂和原子之间新键的重新组合,从而形成新的分子,据此进行解答;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)根据盖斯定律及题中热化学方程式计算出反应N2(g)+O2(g)═2NO(g)的△H;
(4)根据增大氧气的浓度,可以使一氧化氮充分利用,一氧化氮尽可能转化成硝酸进行解答.
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)根据盖斯定律及题中热化学方程式计算出反应N2(g)+O2(g)═2NO(g)的△H;
(4)根据增大氧气的浓度,可以使一氧化氮充分利用,一氧化氮尽可能转化成硝酸进行解答.
解答:解:(1)氮气、氢气在催化剂表面合成氨反应过程的顺序为:图①氮气分子和氢气分子向催化剂表面靠近,图②氮气和氢气吸附在催化剂的表面,图③在催化剂的作用下分解成氢原子和氮原子,图④表示氮原子与氢原子重新结合成氨分子,图⑤生成的氨气离开催化剂表面,
故答案为:图②表示N2、H2被吸附在催化剂表面;图③表示在催化剂表面N2、H2中的化学键断裂;
(2)在反应N2+3H2?2NH3中,断裂3molH-H键,1molN≡N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×393kJ=2358kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2358kJ-2254kJ=104kJ,该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-104kJ?mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-104kJ?mol-1;
(3)①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ?mol-1;
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ?mol-1;
根据盖斯定律②÷2-①÷2可得:N2(g)+O2(g)═2NO(g)△H=
(-905.8kJ?mol-1-1266.8kJ?mol-1)=+180.5kJ/mol,
故答案为:+180.5;
(4)吸收塔中通入空气,可以增加氧气的浓度,使NO循环利用,全部转化成HNO3,故答案为:使NO循环利用,全部转化成HNO3.
故答案为:图②表示N2、H2被吸附在催化剂表面;图③表示在催化剂表面N2、H2中的化学键断裂;
(2)在反应N2+3H2?2NH3中,断裂3molH-H键,1molN≡N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×393kJ=2358kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2358kJ-2254kJ=104kJ,该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-104kJ?mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-104kJ?mol-1;
(3)①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ?mol-1;
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ?mol-1;
根据盖斯定律②÷2-①÷2可得:N2(g)+O2(g)═2NO(g)△H=
| 1 |
| 2 |
故答案为:+180.5;
(4)吸收塔中通入空气,可以增加氧气的浓度,使NO循环利用,全部转化成HNO3,故答案为:使NO循环利用,全部转化成HNO3.
点评:本题主要考查了工业合成氨原理、热化学方程式书写等知识,正确解读题目给出的信息是解决信息性题目的关键,要善于从信息中捕捉最有效的信息用来处理问题.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目


 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是