题目内容
10.(1)下列物质含有离子键的是DA.H2 B.CO2 C.NH3 D.NaOH
(2)下列物质中含有共价键的离子化合物是C
A.H2OB.CaCl2C.NH4ClD.HCl
(3)NaCl、NH3的电子式、
 .
.
分析 (1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA族、第IIA族和第VIA族、第VIIA族元素之间易形成离子键;
(2)含有离子键的化合物为离子化合物,离子化合物中可能含有共价键,只含共价键的化合物为共价化合物;
(3)氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的;氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子.
解答 解:(1)N2属于单质分子,分子中只有共价键;CO2、NH3分子中只有共价键;NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,故答案为:D;
(2)A.H2O中只含共价键,为共价化合物,故A错误;
B.CaCl2中只含离子键,不含共价键,属于离子化合物,故B错误;
C.NH4Cl中铵根离子和氯离子之间存在离子键,氮原子和氢原子之间存在共价键,氯离子中氮原子和氧原子之间存在共价键,故C正确;
D.HCl中只含共价键,为共价化合物,故D错误.
故答案为:C;
(3)氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为 ;氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子,氨气分子的电子式为
;氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子,氨气分子的电子式为 ,故答案为:
,故答案为: ;
; .
.
点评 本题考查了化合物和化学键的关系,明确基本概念是解本题关键,根据化合物中存在的化学键来分析解答,题目难度不大.

练习册系列答案
相关题目
20.下列电池中,对环境友好的是( )
| A. |  锌锰干电池 | B. |  铅蓄电池 | C. |  氢燃料电池 | D. |  镍镉电池 |
1.下列叙述中正确的是( )
| A. | 在多电子的原子里,能量高的电子通常顺离核近的区域内运动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了K层后才排L层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 微粒的最外层只能是8个电子才稳定 |
5.H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-akJ/mol
已知a、b、c均大于零.下列说法正确的是( )

已知a、b、c均大于零.下列说法正确的是( )
| A. | H2、I2和HI分子中的化学键都是非极性共价键 | |
| B. | 断开2mol HI分子中的化学键所需能量约为(c+b+a)kJ | |
| C. | 相同条件下,1mol H2(g)和1mol I2(g)总能量小于2molHI(g)的总能量 | |
| D. | 向密闭容器中加入2mol H2(g)和2mol I2(g),充分反应后放出的热量小于2a kJ |
15.下列分散系中的分散质粒子大小属于纳米级(1-100nm)的是( )
| A. | Fe(OH)3胶体 | B. | Fe(OH)3沉淀 | C. | FeCl3溶液 | D. | 油水混合物 |
2.下列判断正确的是( )
| A. | 沸点:CH4>NH3>H2O | B. | 得电子能力:C>N>O | ||
| C. | 酸性:H2SO4>HClO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
20.下列说法中,正确的是( )
| A. | 化学键是原子间的相互作用 | |
| B. | 离子键是阴阳离子间的静电吸引 | |
| C. | 化学键被破坏的变化一定是化学变化 | |
| D. | 共价化合物中一定不含离子键 |
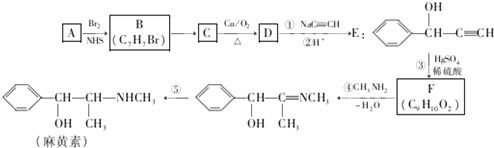
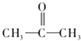
 .
. .
.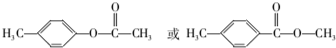 .
. 的合成路线,其它试剂及溶剂任选.
的合成路线,其它试剂及溶剂任选.