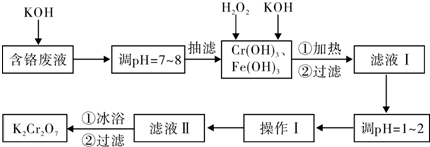
题目内容
恒温、恒压下,在一个可变容积的容器中发生如下反应:A(气)+B(气)?C(气).
①若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为 mol.
②若开始时放入2molA和2molB,到达平衡后,生成C的物质的量为 mol,C的体积分数是 .
①若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为
②若开始时放入2molA和2molB,到达平衡后,生成C的物质的量为
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)依据化学平衡的三段式计算列式分析计算;
(2)根据恒温、恒压下放入3molA和3molB,最后达到与(1)相同的平衡分析计算.
(2)根据恒温、恒压下放入3molA和3molB,最后达到与(1)相同的平衡分析计算.
解答:
解;(1)根据化学平衡三段式列式计算
A(气)+B(气)?C(气)
起始量(mol) 1 1 0
变化量(mol) a a a
平衡量(mol) 1-a 1-a a
A的物质的量为(1-a)mol;
故答案为:(1-a);
(2)若开始时放入2molA和2molB,最后达到与(1)相同的平衡,所以到达平衡后,依据(1)中的计算,生成C的物质的量为2amol;平衡时A的物质的量为(2-2a
)mol,B为(2-2a)mol,C的体积分数为:
×100%=
×100%,
故答案为:2a;
%.
A(气)+B(气)?C(气)
起始量(mol) 1 1 0
变化量(mol) a a a
平衡量(mol) 1-a 1-a a
A的物质的量为(1-a)mol;
故答案为:(1-a);
(2)若开始时放入2molA和2molB,最后达到与(1)相同的平衡,所以到达平衡后,依据(1)中的计算,生成C的物质的量为2amol;平衡时A的物质的量为(2-2a
)mol,B为(2-2a)mol,C的体积分数为:
| 2a |
| (2-2a)+(2-2a)+2a |
| a |
| 2-a |
故答案为:2a;
| 100a |
| 2-a |
点评:本题考查了化学平衡的计算,等效平衡的分析应用和判断,充分利用各步的隐含条件,依据等效平衡的特征分析计算是本题的关键.

练习册系列答案
相关题目
下列说法不科学的是( )
| A、自然界“水滴石穿”的主要原因用方程式表示为:CaCO3+H2O+CO2═Ca(HCO3)2 |
| B、“雨后彩虹”是与胶体、光学等知识有关的自然现象 |
| C、人类目前直接利用的能量大部分是由化学反应产生的 |
| D、“生物固氮”是指植物通过叶片直接吸收空气中的氮气 |
下列说法正确的是( )
| A、CH4的摩尔质量为16 |
| B、1 mol H2O的质量为18 g/mol |
| C、同温同压下,气体的密度与气体的相对分子质量成正比 |
| D、在相同温度条件下,气体分子间的平均距离几乎相等 |

 某化学兴趣小组将两份等质量的硫粉分别在空气、氧气中燃烧,放出的热量是一样多还是不一样多?经过讨论、综合,根据观点分成了两组.
某化学兴趣小组将两份等质量的硫粉分别在空气、氧气中燃烧,放出的热量是一样多还是不一样多?经过讨论、综合,根据观点分成了两组.