题目内容
下列有关说法正确的是( )
| A、在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应 | ||
| B、锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡后再用酸溶解去除 | ||
C、室温下,将浓度为0.1mol.L?1HF溶液加水稀释,其电离平衡常数和
| ||
| D、电解精练铜时,阳极泥中常含有金属金、银、锌等 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,吸热反应和放热反应,弱电解质在水溶液中的电离平衡,电解原理
专题:化学反应中的能量变化,电离平衡与溶液的pH专题,电化学专题
分析:A、反应吸热放热反应由反应物和生成物能量决定,加热反应不一定是吸热反应;
B、硫酸钙转化为碳酸钙沉淀,加酸便于除去;
C、弱电解质溶液稀释,促进电离,平衡常数是随温度变化的物理量;
D、阳极中的锌是活泼金属通电失去电子发生氧化反应.
B、硫酸钙转化为碳酸钙沉淀,加酸便于除去;
C、弱电解质溶液稀释,促进电离,平衡常数是随温度变化的物理量;
D、阳极中的锌是活泼金属通电失去电子发生氧化反应.
解答:
解:A、反应需在300℃进行是为了获得较快的反应速率,不能说明反应是吸热还是放热,故A错误;
B、硫酸钙微溶,加入碳酸钠溶液可以生成碳酸钙,实现沉淀转化,加酸除去,故B正确;
C、氢氟酸是弱酸存在电离平衡,加水稀释促进电离,
比值增大,平衡常数只随温度变化,所以稀释溶液平衡常数不变,故C错误;
D、电解精练铜时,阳极泥中常含有金属金、银等不活泼金属,锌在阳极失电子发生氧化反应,故D错误;
故选B.
B、硫酸钙微溶,加入碳酸钠溶液可以生成碳酸钙,实现沉淀转化,加酸除去,故B正确;
C、氢氟酸是弱酸存在电离平衡,加水稀释促进电离,
| c(H+) |
| c(HF) |
D、电解精练铜时,阳极泥中常含有金属金、银等不活泼金属,锌在阳极失电子发生氧化反应,故D错误;
故选B.
点评:本题考查了化学反应的能量变化,沉淀转化的应用,弱电解质的电离平衡分析判断,溶液稀释平衡常数的变化判断,电极精炼的原理应用.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
氧化钙是碱性氧化物,下列关于氧化钙性质叙述不正确的是( )
| A、氧化钙可以与水反应生成碱 |
| B、氧化钙可以与盐酸反应 |
| C、氧化钙可以和Na2O反应 |
| D、氧化钙可以与CO2反应 |
下列关于晶体的说法正确的是( )
| A、在晶体中只要有阳离子就一定有阴离子 |
| B、晶体中分子间作用力越大,分子越稳定 |
C、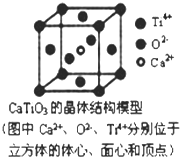 CaTiO3晶体中(晶胞结构如图所示)与每个Ti4+紧邻且等距的O2-有12个 |
| D、SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
关于NaHCO3溶液的表述正确的是( )
| A、c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) |
| B、c (Na+)+c (H+)=c (HCO3-)+c (CO32-)+c (OH-) |
| C、HCO3- 的电离程度大于HCO3-的水解程度 |
| D、其电离方程式为:NaHCO3?Na++H++CO32- |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如图所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A、Y元素最高价氧化物对应的水化物化学式为H3YO4 |
| B、原子半径由小到大的顺序为X<Z<Y<W |
| C、与同浓度的盐酸反应,Z比W 更剧烈 |
| D、X、Z两种元素氧化物中所含化学键的类型相同 |

 的反应条件是
的反应条件是