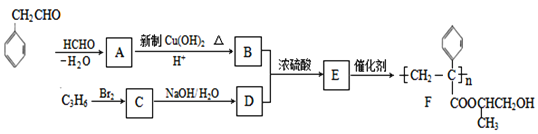
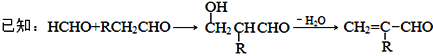
题目内容
【题目】已知下列数据:
物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙 醇 | -114 | 78.4 | 0.79 |
乙 酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓H2SO4 | 338 | 1.84 |



实验室制取乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比2:3:2的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到盛有10mL饱和Na2CO3溶液的(加入2滴酚酞试液)试管中;③小火加热试管中的混合液;④待小试管中收集约2mL产物时停止加热,撤出小试管并用力振荡,然后静置;⑤分离出纯净的乙酸乙酯。请回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是_____________________________;
(2)写出该实验制取乙酸乙酯的化学方程式_________________________________,浓H2SO4的作用是 _______________________;
(3)步骤③中,用小火加热试管中的混合液,其原因_________________________;
(4)步骤④所观察到的现象是___________________________________________________
(5)步骤⑤中,分离出乙酸乙酯的方法是_________________________________;
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取圆底烧瓶中产物)。你认为哪种装置更合理,为什么?_____。
【答案】 先向试管中加入3mL乙醇,再缓缓加入2mL浓H2SO4和2mL乙酸,边加边振荡。 CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O 催化剂,吸水剂 乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量挥发损失 有气泡产生,溶液分层,下层溶液红色变浅 分液 乙;反应物能冷凝回流,提高乙酸乙酯的产率
CH3COOCH2CH3 + H2O 催化剂,吸水剂 乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量挥发损失 有气泡产生,溶液分层,下层溶液红色变浅 分液 乙;反应物能冷凝回流,提高乙酸乙酯的产率
【解析】分析:(1)乙酸、乙醇和浓硫酸混合时相当于浓硫酸稀释,据此解答;
(2)在浓硫酸作催化剂、加热条件下,乙酸和乙醇发生酯化反应生成乙酸乙酯;浓硫酸具有吸水性和催化能力;
(3)乙酸、乙醇、乙酸乙酯沸点接近且较低,温度高时三者都易挥发;
(4)生成的乙酸乙酯中含有乙醇和乙酸,乙醇极易溶于水,乙酸和碳酸钠反应生成乙酸钠、二氧化碳和水,导致溶液碱性降低;
(5)根据乙酸乙酯不溶于水解答;
(6)甲、乙的区别是乙装置能冷凝回流,据此判断。
详解:(1)乙酸、乙醇和浓硫酸混合时相当于浓硫酸稀释,所以应该将浓硫酸加入乙醇和乙酸的混合溶液中,并不断振荡,防止局部温度过高而产生安全事故,即先向试管中加入3mL乙醇,再缓缓加入2mL浓H2SO4和2mL乙酸,边加边振荡;
(2)在浓硫酸作催化剂、加热条件下,乙酸和乙醇发生酯化反应生成乙酸乙酯,反应方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。由于酯化反应是可逆反应,则浓硫酸的作用除了作催化剂以外,还作吸水剂;
CH3COOCH2CH3+H2O。由于酯化反应是可逆反应,则浓硫酸的作用除了作催化剂以外,还作吸水剂;
(3)乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失,降低产率,所以用小火加热;
(4)乙酸乙酯是难溶于碳酸钠溶液的无色液体,碳酸钠溶液呈碱性,酚酞遇碱变红色,所以碳酸钠溶液呈红色,生成的乙酸乙酯中含有乙醇和乙酸,乙醇极易溶于水,乙酸和碳酸钠反应生成乙酸钠、二氧化碳和水,导致溶液碱性降低,所以看到的现象是有气泡产生,溶液分层,下层溶液红色变浅;
(5)分离互不相溶的液体采用分液方法,乙酸乙酯不溶于水,所以步骤⑤中,分离出乙酸乙酯的方法是分液;
(6)甲、乙的区别是乙装置中反应物能冷凝回流,提高乙酸乙酯的产率,所以选乙。

【题目】下列有关实验现象、解释和结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 |
B | 淀粉水解后的溶液加入新制Cu(OH)2浊液,再加热 | 无砖红色沉淀 | 淀粉水解产物不含醛基 |
C | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1 mol/L的NaI溶液,再振荡, | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D