题目内容
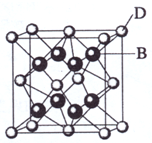
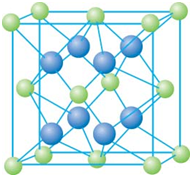 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:(1)A元素的名称是
氢
氢
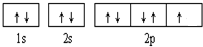
;(2)B元素的轨道表示式是


氟化氢分子间存在氢键,氯化氢分子间没有氢键
氟化氢分子间存在氢键,氯化氢分子间没有氢键
;(3)E属于元素周期表中第
四
四
周期,第VIIB
VIIB
族的元素,其元素名称是锰
锰
;属于元素周期表中的d
d
区(填元素分区),它的+2价离子的电子排布式为1s22s22p63s23p63d5
1s22s22p63s23p63d5
;(4)从图中可以看出,D跟B形成的离子化合物的化学式为
CaF2
CaF2
;该离子化合物晶体的密度为a g?cm-3,则晶胞的体积是| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
分析:从D、E是周期表中1-18列中E排第7列可判断E是第4周期VIIB族的Mn元素,原子序数为25,所以D也在第4周期,D的原子序数比E小5,则原子序数为20,应为Ca元素,图中离子化合物D与B的离子个数比值为:(8×
+6×
):8=1:2,且D为Ca,则B的化合价为-1价,应为第ⅦA族元素,B和C属同一主族,B的序数在前面,B为F,C为Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H.
| 1 |
| 8 |
| 1 |
| 2 |
解答:解:从D、E是周期表中1-18列中E排第7列可判断E是第4周期VIIB族的Mn元素,原子序数为25,所以D也在第4周期,D的原子序数比E小5,则原子序数为20,应为Ca元素,图中离子化合物D与B的离子个数比值为:(8×
+6×
):8=1:2,且D为Ca,则B的化合价为-1价,应为第ⅦA族元素,B和C属同一主族,B的序数在前面,B为F,C为Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H.
(1)通过以上分析知,A的名称是氢,
故答案为:氢;
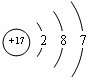
(2)B是F元素,其轨道表示式为: ,C是Cl元素,其原子结构示意图为:
,C是Cl元素,其原子结构示意图为: ;
;
B为F元素,C为Cl元素,A是氢元素,HF中含有氢键,分子间的作用力较强,沸点较高;
故答案为: ;
; ; 氟化氢分子间存在氢键,氯化氢分子间没有氢键;
; 氟化氢分子间存在氢键,氯化氢分子间没有氢键;
(3)E为Mn元素,位于周期表第四周期第七列,则应位于VIIB族,属于d区,原子电子排布式为1s22s22p63s23p63d54s2,原子失去2个电子生成离子,所以离子的电子排布式为 1s22s22p63s23p63d5,
故答案为:四,VIIB; 锰;d区; 1s22s22p63s23p63d5;
(4)从图中可以看出,晶胞中含有Ca的离子个数为:(8×
+6×
)=4,含有F的离子个数为8,二者比值为1:2,
则化学式为CaF2,
晶胞中:ρ=
=
=ag?cm-3,则V=
,
故答案为:CaF2;
.
| 1 |
| 8 |
| 1 |
| 2 |
(1)通过以上分析知,A的名称是氢,
故答案为:氢;
(2)B是F元素,其轨道表示式为:
 ,C是Cl元素,其原子结构示意图为:
,C是Cl元素,其原子结构示意图为: ;
;B为F元素,C为Cl元素,A是氢元素,HF中含有氢键,分子间的作用力较强,沸点较高;
故答案为:
 ;
; ; 氟化氢分子间存在氢键,氯化氢分子间没有氢键;
; 氟化氢分子间存在氢键,氯化氢分子间没有氢键;(3)E为Mn元素,位于周期表第四周期第七列,则应位于VIIB族,属于d区,原子电子排布式为1s22s22p63s23p63d54s2,原子失去2个电子生成离子,所以离子的电子排布式为 1s22s22p63s23p63d5,
故答案为:四,VIIB; 锰;d区; 1s22s22p63s23p63d5;
(4)从图中可以看出,晶胞中含有Ca的离子个数为:(8×
| 1 |
| 8 |
| 1 |
| 2 |
则化学式为CaF2,
晶胞中:ρ=
| m |
| V |
| ||
| V |
| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
故答案为:CaF2;
| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
点评:本题以元素推断为基础,除考查元素名称、位置及电子排布式之外,还设计了有关影响晶体熔沸点高低的原因、晶胞计算等问题.本题的综合性较大,基本上覆盖了物质结构与性质的主干知识.

练习册系列答案
相关题目
 已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素.回答下列问题:
已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素.回答下列问题:
 (2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.
(2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.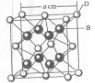 (2011?开封一模)[化学--选修物质结构与性质]
(2011?开封一模)[化学--选修物质结构与性质]