题目内容
16.下列化学试剂在空气中放置不是因氧化而变质的是( )| A. | 苯酚 | B. | 澄清石灰水 | C. | FeSO4 | D. | Na2SO4 |
分析 试剂在空气中易被氧气氧化而变质,说明该物质具有较强的还原性,能被空气中的氧气氧化,据此分析.
解答 解:A、苯酚是无色的晶体,在空气中因为被氧气氧化而变质,为粉红色,故A不选;
B、澄清石灰水在空气中放置因为吸收二氧化碳而生成碳酸钙变浑浊,不是因氧化而变质,故B选;
C、FeSO4在空气中放置会被氧气氧化为硫酸铁而变质,故C不选;
D、硫酸钠性质稳定,不易变质,故D不选.
故选B.
点评 本题考查学生物质的性质以及氧化还原反应的概念和判断,侧重于常见物质的性质的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列各组物质中化学键的类型相同的是( )
| A. | HF MgCl2 NH4Cl | B. | H2S Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH C H4 | D. | NH3 H2O CS2 |
4.下列说法中正确的是( )
| A. | 金属Li、Na、K密度较小,应保存在煤油中 | |
| B. | CuO、Na2O、Mn2O7属于碱性氧化物 | |
| C. | SO2具有漂白性,可使溴水褪色 | |
| D. | 往Fe(OH)3胶体中逐滴加入稀H2SO4会产生沉淀而后沉淀溶解 |
11.设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1molC20H42中含有的共价键数目为60nA | |
| B. | 1molCl2通过足量的NaOH溶液中充分反应转移的电子数为nA | |
| C. | a g 某气体含分子数为b,c g 该气体在标况下的体积为22.4bc/(a nA)升 | |
| D. | 2.24L(标况)辛烷在32 g 氧气中充分燃烧,生成CO2的分子数为0.8nA |
9. 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化.直到因加入一滴盐酸后,溶液由黄色变为橙色,并半分钟内不复原为止.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(D)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
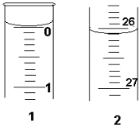
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0.00mL,终点读数为26.10mL;所用盐酸溶液的体积为26.10mL.
(4)某学生根据三次实验分别记录有关数据如表:
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=0.1044mol/L(保留小数点后4位).
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化.直到因加入一滴盐酸后,溶液由黄色变为橙色,并半分钟内不复原为止.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(D)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0.00mL,终点读数为26.10mL;所用盐酸溶液的体积为26.10mL.
(4)某学生根据三次实验分别记录有关数据如表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
 A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).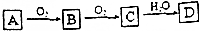

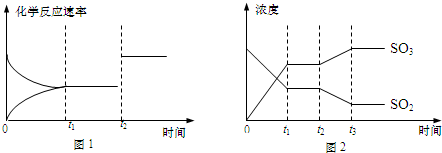
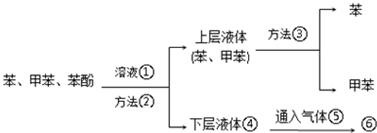
 .
. .
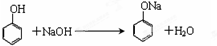
. .
.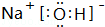 ,其中存在的化学键有离子键、共价键.
,其中存在的化学键有离子键、共价键.