题目内容
对某酸性溶液(可能含有Br-、 、H2SO3、
、H2SO3、 )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在溶液中是否存在的是( )
A.Br- B.
C.H2SO3 D.
【答案】
B
【解析】
试题分析:。①加热时放出的气体可以使品红溶液褪色,则溶液中一定有H2SO3。因H2SO3不稳定,加热分解产生的SO2可使品红溶液褪色。②加碱后,加热放出可使湿润的红色石蕊试纸变蓝色的气体,即有NH3产生,说明溶液中一定有 。③加入氯水时,溶液略显黄色,说明原溶液中含有Br-。再加入BaCl2溶液时,有不溶于稀硝酸的白色沉淀产生,说明此时溶液中含有
。③加入氯水时,溶液略显黄色,说明原溶液中含有Br-。再加入BaCl2溶液时,有不溶于稀硝酸的白色沉淀产生,说明此时溶液中含有 ,但可能是原溶液中含有的,也可能是氯水氧化H2SO3产生的,故不能确定的是
,但可能是原溶液中含有的,也可能是氯水氧化H2SO3产生的,故不能确定的是 ,因此答案选B。
,因此答案选B。
考点:考查离子共存以及物质鉴别的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是熟练记住常见离子的检验原理以及试剂,然后结合题意灵活运用即可。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
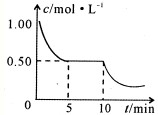
 学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
 (2012?浙江模拟)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
(2012?浙江模拟)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.