题目内容
12.有机物M是合成二氢荆芥内酯的重要原料,结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )| A. | M的分子式为C10H14O | |
| B. | M能发生氧化反应,不能发生还原反应 | |
| C. | M与FeCl3溶液反应生成紫色有机化合物 | |
| D. | 检验M中官能团是先加入新制氢氧化铜,微热,酸化后再加溴水 |
分析 A.根据结构简式确定分子式;
B.M中含有碳碳双键和醛基,具有烯烃和醛的性质;
C.该物质中不含酚羟基,不能发生显色反应;
D.醛基和碳碳双键都能和溴反应,但醛基和氢氧化铜悬浊液反应,和碳碳双键不反应.
解答 解:A.根据结构简式确定分子式为C10H16O,故A错误;
B.M中含有碳碳双键和醛基,具有烯烃和醛的性质,所以能发生氧化反应,也能发生还原反应,故B错误;
C.该物质中不含酚羟基,不能发生显色反应,所以不能和氯化铁溶液反应生成紫色有机化合物,故C错误;
D.醛基和碳碳双键都能和溴反应,但醛基和氢氧化铜悬浊液反应,和碳碳双键不反应,所以检验M中官能团是先加入新制氢氧化铜,微热来检验醛基,然后酸化后再加溴水检验碳碳双键,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃和醛的性质,注意D中官能团检验先后顺序,为易错点.

练习册系列答案
相关题目
2.下列各组离子能大量共存且溶液为无色的是( )
| A. | Na+、Ag+、NO3-、Br- | B. | Cu2+、SO42-、Cl-、H+ | ||
| C. | Na+、Mg2+、SO42-、Cl- | D. | Ca2+、K+、OH-、CO32- |
3.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$?_{甲}^{丁}$丙,下列有关物质的推断不正确的是( )
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为SO2,则丁可能是氨水 | ||
| C. | 若甲为Fe,则丁可能是氯气 | D. | 若甲为NaOH溶液,则丁可能是CO2 |
7.下列叙述一定正确的是( )
| A. | 两份质量相同的镁分别与足量氮气、二氧化碳反应,增重的质量相同 | |
| B. | 两份质量相同的硫分别与足量氢氧化钠和钠反应,两者转移的电子数相同 | |
| C. | 相同物质的量CO2、H2O分别与足量Na2O2反应,生成气体的体积相同 | |
| D. | 氢气分别通过灼热的CuO和Fe2O3粉末,当转移电子数相同时,固体减轻的质量相同 |
17.下列做法正确的是( )
| A. | 金属钠着火,立即用水扑灭 | |
| B. | 稀释浓硫酸时,将水倒入浓硫酸中 | |
| C. | 在量筒中配置100mL,1mol/L NaCl溶液 | |
| D. | 大量氯气泄漏时,尽量沿高处迅速离开现场 |
4.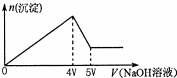 向MgCl2、Al2(SO4)3的混合溶液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则原溶液中Mg2+与Al3+的物质的量之比是( )
向MgCl2、Al2(SO4)3的混合溶液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则原溶液中Mg2+与Al3+的物质的量之比是( )
 向MgCl2、Al2(SO4)3的混合溶液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则原溶液中Mg2+与Al3+的物质的量之比是( )
向MgCl2、Al2(SO4)3的混合溶液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则原溶液中Mg2+与Al3+的物质的量之比是( )| A. | 1:2 | B. | 1:1 | C. | 2:3 | D. | 3:2 |
1.下列有关实验操作的说法错误的是( )
| A. | 中和滴定时盛待测的锥形瓶中有少量水对滴定结果无影响 | |
| B. | 在酸碱中和滴定实验中,滴定管都需要润洗,否则引起误差 | |
| C. | 滴定时,左手控制滴定管的活塞,右手握持锥形瓶,边滴加振荡,眼睛注视滴定管中的液面 | |
| D. | 在酸碱中和滴定实验中,滴定前仰视滴定后俯视会引起误差 |
13.下面关于多电子原子核外电子的运动规律的叙述正确的是( )
| A. | 核外电子是分层运动的 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域运动 | |
| D. | 不同能量的电子在核外运动占有的区域形状可能不同 |