题目内容
写出下列反应的离子方程式.
(1)向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性: ;
(2)向Ca(HCO3)2溶液中滴加足量的NaOH溶液 ;
(3)向含1molFeBr2溶液中通入1molCl2(已知Br2能氧化Fe2+) .
(1)向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:
(2)向Ca(HCO3)2溶液中滴加足量的NaOH溶液
(3)向含1molFeBr2溶液中通入1molCl2(已知Br2能氧化Fe2+)
考点:离子方程式的书写
专题:离子反应专题
分析:(1)硫酸氢钠与氢氧化钡溶液反应成中性,说明硫酸氢钠与氢氧化钡的物质的量之比为2:1,据此写出反应的离子方程式;
(2)由于氢氧化钠足量,所有的碳酸氢根离子完全反应,钙离子不足,反应产物中有剩余的碳酸根离子;
(3)氯气具有氧化性,能将亚铁离子和溴离子氧化,亚铁离子还原性较强,根据电子得失守恒求出被氧化的Br-的物质的量.
(2)由于氢氧化钠足量,所有的碳酸氢根离子完全反应,钙离子不足,反应产物中有剩余的碳酸根离子;
(3)氯气具有氧化性,能将亚铁离子和溴离子氧化,亚铁离子还原性较强,根据电子得失守恒求出被氧化的Br-的物质的量.
解答:
解:(1)反应后的溶液显示中性,说明氢离子与氢氧根离子的物质的量相等,即硫酸氢钠与氢氧化钡的物质的量之比为2:1,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(2)氢氧化钠足量,反应生成碳酸钙、碳酸钠、水,该反应的离子反应为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,
故答案为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-.
(3)氯气具有氧化性,能将亚铁离子和溴离子氧化,先氧化亚铁离子,1mol的FeBr2溶液中通入Cl21mol反应时,两者的物质的量相等,此时Fe2+全部被氧化,溴离子部分被氧化,根据电子得失守恒:n(Cl2)×2=n(Fe2+)×1+n(Br-)×1,即1mol×2=1mol×1+n(Br-)×1,则n(Br-)=1mol,说明溴离子部分被氧化,反应的离子方程式为:2Fe2++2Cl2+2Br-═2Fe3++4Cl-+Br2,
故答案为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-.
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(2)氢氧化钠足量,反应生成碳酸钙、碳酸钠、水,该反应的离子反应为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,
故答案为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-.
(3)氯气具有氧化性,能将亚铁离子和溴离子氧化,先氧化亚铁离子,1mol的FeBr2溶液中通入Cl21mol反应时,两者的物质的量相等,此时Fe2+全部被氧化,溴离子部分被氧化,根据电子得失守恒:n(Cl2)×2=n(Fe2+)×1+n(Br-)×1,即1mol×2=1mol×1+n(Br-)×1,则n(Br-)=1mol,说明溴离子部分被氧化,反应的离子方程式为:2Fe2++2Cl2+2Br-═2Fe3++4Cl-+Br2,
故答案为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-.
点评:本题考查了离子方程式的书写,该题是高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,如难溶物、弱电解质等需要保留化学式,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
电子数相等的微粒叫等电子体,下列微粒组是等电子体的是( )
| A、N2O4和NO2 |
| B、Na+和Cl- |
| C、SO42-和PO43- |
| D、NO和O2 |
西维因是一种高效低毒杀虫剂,在碱性条件下可水解:有关说法正确的是( )


| A、西维因分子式为C12H10NO2 |
| B、反应后的溶液经酸化,不可用FeCl3溶液检验西维因是否已经发生水解 |
| C、水解后的两种有机产物,各有一种官能团 |
| D、西维因分子中至少有21个原子共平面 |

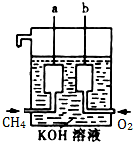 美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:
美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示: