题目内容
17.下列有关叙述正确的是( )| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素周期律的实质是因为元素原子最外层电子数由1→8周期性变化而引起的 | |
| C. | 半径由大到小、氧化性由弱到强的是K+、Mg2+、Al3+、H+,而还原性由弱到强的则是I-、Br-、Cl-、F- | |
| D. | 某元素R的最高价氧化物化学式为R2O5,又知R的气态氢化物中含氢的质量分数为8.8%,则R的相对原子质量为28 |
分析 A.元素的化学性质由价电子决定,而不是相对原子质量;
B.结构决定性质,元素周期律的实质是元素的性质随着元素核电荷数的递增而呈周期性变化
C.元素的非金属性越强,对应的阴离子的还原性越弱;
D.由“某元素的最高价氧化物分子式R2O5”可知,元素R的化合价为+5价;则它跟氢生成的氢化物的化学式为RH3,根据氢化物中含氢为8.82%,可以计算出R的相对原子质量.
解答 解;A.元素的化学性质由价电子决定,而不是相对原子质量,故A错误;
B.元素周期律指元素的性质随着元素的原子序数(即原子核外电子数或核电荷数)的增加呈周期性变化的规律,故B正确;
C.元素的非金属性越强,对应的阴离子的还原性越弱,I-、Br-、Cl-、F-还原性由强到弱,故C错误;
D.由“某元素的最高价氧化物分子式R2O5”可知,元素R的化合价为+5价;则它的氢化物的化学式为RH3,设R的相对原子质量为x,则$\frac{3}{3+x}$×100%=8.82%,解得:x=31,故D错误.
故选B.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质及元素化合物知识为解答的关键,选项AD为解答的易错点,把握规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
7.常温下,下列有关叙述正确的是( )
| A. | 饱和氯水中滴加NaOH至溶液呈中性:c(Na+)═2c(ClO-)+c(HClO) | |
| B. | 100ml 0.2mol/L的NH4Cl溶液和200ml 0.1mol/L的NH4Cl溶液所含有的n(NH4+)相同 | |
| C. | pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)≥c(H+) | |
| D. | 常温下,pH=4.75、浓度均为0.1mol/L的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
8.《化学教育》报道了数起因食用有“瘦肉精”的猪肉和内脏,而发生急性中毒的恶性事件.这足以说明,“瘦肉精”变成了“害人精”.“瘦肉精”的结构可表示为: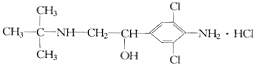
下列说法正确的是( )

下列说法正确的是( )
| A. | 摩尔质量为313.5 g | B. | 属于芳香烃 | ||
| C. | 分子式为C12H19Cl3N20 | D. | 消去产物有2种 |
5.下表为部分短周期元素化合价及相应氢化物沸点的数据:
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:r(S2-)>r(Cl-)>r(O2-).比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.(均用实际的元素符号表示)
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bc(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现.
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:r(S2-)>r(Cl-)>r(O2-).比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.(均用实际的元素符号表示)
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bc(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现.
12.下列说法正确的是( )
| A. | CH3CH2 CH3的三个碳原子在一条直线 | |
| B. | CH2=CHCH3三个碳原子共平面 | |
| C. |  七个碳原子共平面 七个碳原子共平面 | |
| D. | CH4所有原子共平面 |
2.已知2A(g)+B(g)?2C(g)△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A和1mol B,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量为b kJ.
(1)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”“=”或“<”).
若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度=(填“>”、“=”或“<”)w mol/L,a、b、c之间满足何种关系a=b+c(用代数式表示).
(2)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是D.
A.4mol A和2mol B B.4mol A、2mol B和2mol C
C.4mol A和4mol B D.6mol A和4mol B
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C气体 B.适当升高温度C.增大B的浓度 D.选择高效催化剂
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A和1mol B,500℃时充分反应达平衡后,放出热量为d kJ,则d>b(填“>”“=”或“<”).
(5)在一定温度下,向一个容积可变的容器中,通入3mol A和2mol B及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4mol A、3mol B和2mol C,则平衡时A的百分含量不变(填“不变”“变大”“变小”或“无法确定”).
(1)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”“=”或“<”).
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(2)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是D.
A.4mol A和2mol B B.4mol A、2mol B和2mol C
C.4mol A和4mol B D.6mol A和4mol B
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C气体 B.适当升高温度C.增大B的浓度 D.选择高效催化剂
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A和1mol B,500℃时充分反应达平衡后,放出热量为d kJ,则d>b(填“>”“=”或“<”).
(5)在一定温度下,向一个容积可变的容器中,通入3mol A和2mol B及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4mol A、3mol B和2mol C,则平衡时A的百分含量不变(填“不变”“变大”“变小”或“无法确定”).
9.下列选择的条件符合勒夏特列原理的是( )
| A. | 硫酸工业中合成三氧化硫采用常压条件 | |
| B. | 合成氨工业采用高压 | |
| C. | 硫酸工业选用浓硫酸吸收三氧化硫 | |
| D. | 合成氨工业采用500度左右的温度 |
7.某物质中可能有甲酸、乙酸、甲醇和甲酸乙酯四种物质中的一种或几种.在鉴定时有下列现象:①有银镜反应;②加入新制的Cu(OH)2 悬浊液后未发现变澄清;③与含酚酞的NaOH溶液共热,红色逐渐消失.下列结论正确的是( )
| A. | 有甲酸乙酯,可能有甲醇 | B. | 有甲酸乙酯和甲酸 | ||
| C. | 有甲酸乙酯和甲醇 | D. | 几种物质均存在 |
