题目内容
2.镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的.主要步骤如下图所示,下列有关说法正确的是( )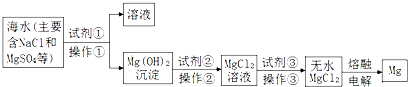
| A. | 试剂①可以选用的试剂是熟石灰,操作①的方法是过滤 | |
| B. | 试剂②可以选用的试剂是盐酸 | |
| C. | 操作③是直接将MgCl2溶液加热蒸发得到无水MgCl2晶体 | |
| D. | 无水MgCl2在通电时发生电离,电解后得到单质Mg. |
分析 海水中加入试剂①氢氧化钙沉淀镁离子生成氢氧化镁沉淀,操作①为过滤操作,过滤后在氢氧化镁沉淀中加入试剂②盐酸溶解,得到氯化镁溶液,通过操作③浓缩蒸发,冷却结晶得到氯化镁晶体,在氯化氢气流中加热失水得到无水氯化镁,电解熔融氯化镁得到金属镁;
A.试剂①可以选用的试剂是熟石灰,沉淀镁离子,分离固体和溶液的操作方法是过滤;
B.分析可知试剂②是盐酸溶解氢氧化镁沉淀;
C.氯化镁溶液水解生成氢氧化镁和氯化氢,蒸发氯化氢挥发促进水解得到氢氧化镁沉淀;
D.氯化镁加热熔融电离,不需要通电;
解答 解:海水中加入试剂①氢氧化钙沉淀镁离子生成氢氧化镁沉淀,操作①为过滤操作,过滤后在氢氧化镁沉淀中加入试剂②盐酸溶解,得到氯化镁溶液,通过操作③浓缩蒸发,冷却结晶得到氯化镁晶体,在氯化氢气流中加热失水得到无水氯化镁,电解熔融氯化镁得到金属镁;
A.分析可知试剂①可以选用的试剂是熟石灰,用来沉淀镁离子,分离固体和溶液的操作方法是过滤,故A正确;
B.分析可知试剂②是盐酸溶解氢氧化镁沉淀,故B正确;
C.氯化镁溶液水解生成氢氧化镁和氯化氢,蒸发氯化氢挥发促进水解得到氢氧化镁沉淀,不能得到氯化镁晶体,故C错误;
D.氯化镁加热熔融电离,不需要通电,故D错误;
故选AB.
点评 本题考查了海水资源的分析应用,主要是海水提镁的过程分析判断,注意氯化镁溶液蒸发浓缩会促进水解,题目难度中等.

练习册系列答案
相关题目
12.X、Y、Z、W 四种短周期元素在周期表中位于连续的四个主族,相对位置如图所示.Z元素原子核外K层与M层电子数相等.下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | 原子半径由小到大的顺序为Y<X<W<Z | |
| B. | Y的单质和Z的单质能够发生反应 | |
| C. | X的单质都是熔点高、硬度大的物质 | |
| D. | 工业上利用电解Z、W的熔融氯化物的方法制备对应的单质 |
13.下列关于元素化合价的叙述中,错误的是( )
| A. | ⅢA族的B和Al都能形成+3价的化合物 | |
| B. | ⅤA族的N和P都能形成-3价的化合物 | |
| C. | ⅠA族的Na和K都能形成+1价的化合物 | |
| D. | ⅦA族的F和Cl都能形成+7价的化合物 |
10.丙烯酸(CH2=CH-COOH)可发生的化学反应类型 ①加成②氧化③酯化④加聚( )
| A. | 只有①②③ | B. | 只有②③④ | C. | 只有①③④ | D. | 全部 |
17.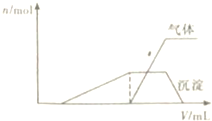 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示.
①则该溶液中一定不含有的离子是H+、NH4+、Al3+;
②可能存在的阳离子有K+;
③肯定不存在的阴离子是ClO-、AlO2-.
(2)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向2L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题.
①a的值为0.15;
②当通入Cl2的体积为3.36L(标准状态下)时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2;此时溶液中Br-、I-的物质的量浓度分别为c(Br-)=0.75mol/L,c(I-)=0.05mol/L.
 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+、NH+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
①则该溶液中一定不含有的离子是H+、NH4+、Al3+;
②可能存在的阳离子有K+;
③肯定不存在的阴离子是ClO-、AlO2-.
(2)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向2L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题.
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
②当通入Cl2的体积为3.36L(标准状态下)时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2;此时溶液中Br-、I-的物质的量浓度分别为c(Br-)=0.75mol/L,c(I-)=0.05mol/L.
7.下列说法正确的是( )
①硅在自然界中以游离态和化合态两种形式存在;
②SiO2是由1个Si原子和2个O原子形成的SiO2分子;
③水泥是硅酸盐材料;
④光导纤维的主要成分是Si单质;
⑤氮化硅陶瓷可做柴油机受热面的材料;
⑥水玻璃可以用作木材防火材料;
⑦硅胶可以做干燥剂;
⑧氢氟酸可以用来刻蚀玻璃.
①硅在自然界中以游离态和化合态两种形式存在;
②SiO2是由1个Si原子和2个O原子形成的SiO2分子;
③水泥是硅酸盐材料;
④光导纤维的主要成分是Si单质;
⑤氮化硅陶瓷可做柴油机受热面的材料;
⑥水玻璃可以用作木材防火材料;
⑦硅胶可以做干燥剂;
⑧氢氟酸可以用来刻蚀玻璃.
| A. | ①②③④⑤ | B. | ②③④⑥⑧ | C. | ③⑤⑥⑦⑧ | D. | ③④⑤⑥⑧ |
11.下列物质中含有极性共价键的是( )
| A. | 单质碘 | B. | 氯化钠 | C. | 水 | D. | 氢气 |
12.25℃时,以下溶液的pH不相同的是( )
| A. | c(Cl-)=c(CH3COO-)的盐酸和醋酸溶液 | |
| B. | 水的电离程度相同的稀硫酸和盐酸 | |
| C. | 水的电离程度相同的氯化按溶液和硫酸铜溶液 | |
| D. | 铵根离子浓度相同的硫酸铵和硫酸氢铵溶液 |