题目内容
【题目】雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一。已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)![]() 2NO(g)ΔH1=a kJ·mol-1
2NO(g)ΔH1=a kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g)ΔH2=b kJ·mol-1
2NO2(g)ΔH2=b kJ·mol-1
③CO(g)+![]() O2(g)
O2(g)![]() CO2(g)ΔH3=c kJ·mol-1
CO2(g)ΔH3=c kJ·mol-1
④2CO(g)+2NO(g)![]() N2(g)+2CO2(g)ΔH4
N2(g)+2CO2(g)ΔH4
请回答下列问题:
(1)根据反应①②③,确定反应④中ΔH4=________ kJ·mol-1。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp=____________________________________(用表达式表示)。
(3)下列情况能说明反应②已达平衡状态的是________(填字母)。
a.单位时间内生成1 mol NO2的同时消耗了1 mol NO
b.在恒温恒容的容器中,混合气体的密度保持不变
c.在绝热恒容的容器中,反应的平衡常数不再变化
d.在恒温恒压的容器中,NO的体积分数保持不变
(4)试分析高温下不利于反应③自发进行的原因______________________________。
(5)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图所示的曲线。试分析实际化工生产中不采用高压的原因______________________________。

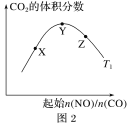
(6)探究反应④中平衡时CO2的体积分数与反应物中起始n(NO)/n(CO)的比值、温度的关系,得到如图所示的曲线。在X、Y、Z三点中,CO的转化率从大到小的顺序是____________________。
【答案】2c-a ![]() CD 因为该反应的ΔH<0,ΔS<0 常压时NO的平衡转化率已较高且高压要增加生产成本 Z>Y>X
CD 因为该反应的ΔH<0,ΔS<0 常压时NO的平衡转化率已较高且高压要增加生产成本 Z>Y>X
【解析】
(1)根据盖斯定律,反应②×2-③即得,确定反应④2CO(g)+2NO(g)![]() N2(g)+2CO2(g),据此计算焓变;
N2(g)+2CO2(g),据此计算焓变;
(2)根据反应①的方程式得出Kp=![]() ;
;
(3)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(4)根据该反应为气体体积减小的放热反应结合△G=△H-T△S<0自发判断;
(5)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大,据此分析;
(6)①温度一定,随反应物NO、CO的起始物质的量比增大,X-Y反应正向进行,一氧化碳的转化率X<Y,Y-Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z;
(1)根据盖斯定律,反应②×2③即得,确定反应④2CO(g)+2NO(g)N2(g)+2CO2(g)△H4=(2ca)kJ/mol;
故答案为:2ca;
(2)根据反应①的方程式得出Kp=![]() ;
;
故答案为:![]() ;
;
(3)A. 单位时间内生成1molNO2的同时消耗了lmolNO,都是正反应,故不能说明达到平衡状态,故A错误;
B.根据ρ=![]() 可知,气体总质量一定,体积一定,故密度一定,故混合气体的密度不再发生改变不能说明达到平衡状态,故B错误;
可知,气体总质量一定,体积一定,故密度一定,故混合气体的密度不再发生改变不能说明达到平衡状态,故B错误;
C. 因为平衡常数仅与温度有关,当平衡常数不再变化,即反应的温度不变,又在绝热恒容的容器中,所以反应的平衡常数不再变化能说明达到平衡状态,故C正确;
D. 在恒温恒压的容器中,NO的体积分数保持不变,则反应达平衡,能说明达到平衡状态,故D正确;
答案选CD;
(4)因为该反应为气体体积减小的放热反应,即△H<0,△S<0,所以在高温下△G=△HT△S>0非自发;
故答案为:因为该反应为气体体积减小的放热反应,即△H<0,△S<0;
(5)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大;
故答案为:常压下NO的转化率已经较高,并且高压要增加成本;
(6)①温度一定,随反应物NO、CO的起始物质的量比增大,XY反应正向进行,一氧化碳的转化率X<Y,YZ平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z,X、Y、Z三点,CO的转化率的从大到小的顺序Z>Y>X;
故答案为:Z>Y>X。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
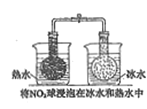
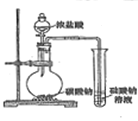
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D