题目内容
【题目】某小组同学设计实验实现几种价态硫元素的转化。
任务I:从以下试剂中选择合适的试剂实现S (+6)→S(+4)的转化。
试剂清单:①浓H2SO4 ②稀H2SO4 ③酸性KMnO4溶液 ④Na2SO3溶液 ⑤Cu ⑥品红
(1)写出实现转化的化学方程式_______________
(2)设计实验,证明实现了该转化(写出操作和现象)_______________。
II:实现硫元素在0、+2、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
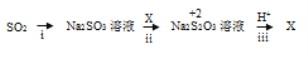
(3)i中加入的物质是__________ ,该转化利用的是SO2的_______性质。
(4)写出iii的离子方程式_____________。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 将产生的气体通入品红溶液中,溶液褪色 NaOH溶液 酸性氧化物 2H++S2O32- = S↓+SO2↑+H2O
CuSO4+SO2↑+2H2O 将产生的气体通入品红溶液中,溶液褪色 NaOH溶液 酸性氧化物 2H++S2O32- = S↓+SO2↑+H2O
【解析】
I:(1)要实现S (+6)→S(+4)的转化,即反应过程中+6价的硫元素被还原为+4价的硫元素,也就是说含+6价的硫做氧化剂,+4价硫的物质做还原产物,需要加入还原剂完成上述转化过程;根据试剂清单,结合物质性质分析,能符合转化过程的为①浓H2SO4与⑤Cu反应生成硫酸铜、二氧化硫和水;
(2)要证明实现了该转化只需要证明产生二氧化硫,结合二氧化硫的性质证明即可;
II:(3)二氧化硫转变为亚硫酸钠过程中硫元素没有发生化合价变化,完成该转化过程,结合二氧化硫是酸性氧化物与碱反应的性质解答;
(4)根据题干信息,+2价硫在酸性条件下不稳定,易发生自身氧化还原反应,即发生歧化反应,+2价的硫化合价及升高又降低,结合步骤ii的反应亚硫酸钠和X反应生成硫代硫酸钠分析可得X中硫的化合价应低于+2价。
I:(1)要实现S (+6)→S(+4)的转化,即反应过程中+6价的硫元素被还原为+4价的硫元素,也就是说含+6价的硫做氧化剂,+4价硫的物质做还原产物,需要加入还原剂完成上述转化过程;根据试剂清单,结合物质性质分析,能符合转化过程的为①浓H2SO4与⑤Cu反应生成硫酸铜、二氧化硫和水,反应方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)要证明实现了该转化只需要证明产生二氧化硫,结合二氧化硫的漂白性,可将反应后产生的气体通入品红溶液中,若溶液褪色,即为实现上述转化,故答案为:将产生的气体通入品红溶液中,溶液褪色;
II:(3)二氧化硫转变为亚硫酸钠过程中硫元素没有发生化合价变化,完成该转化过程,结合二氧化硫是酸性氧化物与氢氧化钠溶液反应生成亚硫酸钠,故答案为:NaOH溶液;酸性氧化物;
(4)根据题干信息,+2价硫在酸性条件下不稳定,易发生自身氧化还原反应,即发生歧化反应,+2价的硫化合价及升高又降低,结合步骤ii的反应亚硫酸钠和X反应生成硫代硫酸钠分析可得X中硫的化合价应低于+2价,则X为硫单质,发生的反应为:2H++S2O32- = S↓+SO2↑+H2O,故答案为:2H++S2O32- = S↓+SO2↑+H2O。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案