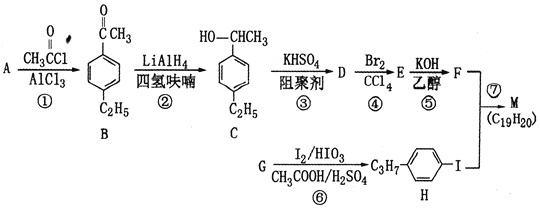
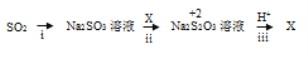题目内容
【题目】聚合硫酸铁简称聚铁[Fe2(OH)6-2n(SO4)n]m广泛用于饮用水等的净化。某化工厂利用硫酸铜废液制备聚铁,其流程如下:

回答下列问题:
(1)试剂A为__________。
(2)本实验中两次加入硫酸,其中“加热浓缩“时加入稀硫酸,除了抑制离子水解,还为了_______,“聚合”时加硫酸是为了控制溶液的pH在一定范围内,若pH偏大,则_________。
(3)“控温氧化”时选用绿色氧化剂双氧水,该过程需要控温的原因是________。
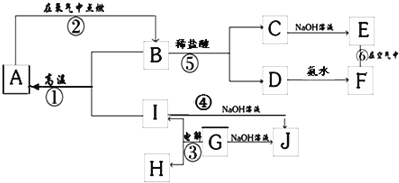
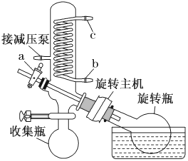
(4)减压蒸发装置如图所示。实验开始时,应先打开减压泵,从_____(填字母)口通入冷水,再打开旋转主机;实验结束时应先关闭旋转主机,再_______,打开阀门a通大气后,最后取下______(填仪器名称),从中获得聚铁。本实验采取减压蒸发的理由是___________。
(5)测定聚合硫酸铁样品主要成分的化学式。准确称取所得聚铁样品5.520g,溶于适量稀盐酸中,然后分成两等份:
a.一份加入过量的BaCl2溶液,然后过滤、洗涤、干燥,称重,得固体质量1.165g;
b.另一份置于250mL锥形瓶中,加入过量KI,充分反应后再用0.5000 molL-1Na2S2O3溶液滴定至终点,消耗标准溶液20.00mL。
已知:I2+2S2O32–=2I–+S4O62–(无色)
①计算所得产品化学式中n=_______。
②若m=4,写出“聚合”过程的化学方程式:______。
【答案】铁粉 增加H+浓度,提高双氧水的氧化能力(或促进Fe2+被氧化) Fe3+容易转化成Fe(OH)3沉淀,导致聚铁产率降低 温度过低反应速率慢,温度过高双氧水分解 b 关闭减压泵 旋转瓶 降低蒸发温度,防止加热时聚铁分解 1 4Fe2(SO4)3+16H2O=[Fe2(OH)4SO4]4+8H2SO4
【解析】
分析制备流程,利用硫酸铜废液制备聚铁,则将硫酸铜废液除酸后,需先加入一定量的铁粉,搅拌、过滤,得到硫酸亚铁溶液。向其中加入少量硫酸,一方面可在加热浓缩时抑制Fe2+的水解,另一方面为下一步氧化提供酸性环境,提高双氧水的氧化能力。通过双氧水将Fe2+氧化为Fe3+。该步骤注意控制反应温度。之后加入水和稀硫酸进行聚合,最后通过减压蒸发得到聚铁。据此分析解答。
(1)根据原料和产品可知将硫酸铜废液转化为聚铁,故硫酸铜废液除酸后,加入一定量铁粉,则可知试剂A为铁粉。答案为:铁粉;
(2)由分析可知,加入少量稀硫酸,除了在加热浓缩时抑制Fe2+的水解,还为下一步氧化提供酸性环境,提高双氧水的氧化能力。“聚合”时加硫酸是为了控制溶液的pH在一定范围内,若pH偏小时,Fe3+水解程度弱,pH偏大时,Fe3+容易转化成Fe(OH)3沉淀,导致聚铁产率降低;答案为:增加H+浓度,提高双氧水的氧化能力(或促进Fe2+被氧化);Fe3+容易转化成Fe(OH)3沉淀,导致聚铁产率降低;
(3)控制温度在一定范围内,一方面是为了加快反应速率,另一方面是防止双氧水分解,答案为:温度过低反应速率慢,温度过高双氧水分解;
(4)该装置使用减压泵给系统减压,降低溶液的沸点,可以在较低温度下蒸馏,避免产品聚铁分解。实验开始时,先打开减压泵使系统处于负压状态,再从用于冷凝蒸出物的(蛇形)冷凝管下口即b口通入冷水,从上口即c口排出;要将聚铁与水分离,因为水的沸点相对聚铁要低,故水浴锅温度调至减压条件下水的沸点附近,打开电动机转动旋转瓶,旋转瓶置于水浴中一边旋转,一边加热,可以增大蒸发面积,利于瓶内溶液扩散蒸发。结束时应先停止旋转电动机,防止蒸馏烧瓶在转动中脱落,再打开通气阀通大气,然后取下收集瓶和旋转瓶。实验中通过水浴加热是蒸发溶剂水,故水在收集瓶中,聚铁在旋转瓶中,取下旋转瓶得聚铁。答案为:b;关闭减压泵;旋转瓶;降低蒸发温度,防止加热时聚铁分解;
(5)①n(SO42-)=n(BaSO4)=![]() ,依据关系式:2Fe3+~I2~2S2O32-,可知n(Fe3+)=n(S2O32-)=
,依据关系式:2Fe3+~I2~2S2O32-,可知n(Fe3+)=n(S2O32-)=![]() ,
,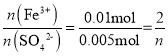 ,n=1。答案为:1;
,n=1。答案为:1;
②若m=4,说明Fe2(SO4)3“聚合”生成[Fe2(OH)4SO4]4,即部分Fe3+水解,反应方程式为:4Fe2(SO4)3+16H2O=[Fe2(OH)4SO4]4+8H2SO4。答案为:4Fe2(SO4)3+16H2O=[Fe2(OH)4SO4]4+8H2SO4。

 阅读快车系列答案
阅读快车系列答案【题目】实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 取一定量固体溶解,向溶液中通入足量的CO,观察到有晶体析出 | 原固体中一定含Na2CO3 |
B | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成 | 原固体中一定含有Na2CO3 |
C | 取一定量固体,溶解,向溶液中滴加适量AgNO3 溶液,观察有白色沉淀生成 | 原固体中一定含有NaCl |
D | 称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到有0.88g气体 | 原固体中三种物质都有 |
A.AB.BC.CD.D