题目内容
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,请完成下列问题: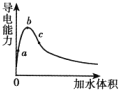
(1)a、b、c三点对应溶液的c(H+)由小到大的顺序为_____________。
(2)a、b、c三点对应溶液中,醋酸电离程度最大的是_____________。
(3)试说明醋酸的导电能力与加水量变化的原因:_____________。
【答案】 a<c<b c 0—b电离占主要因素,离子浓度增大,b—c稀释占主要因素,离子浓度下降
【解析】(1)溶液的导电能力由离子浓度决定,导电能力越强,离子浓度越大,所以为a<c<b
(2)弱电解质的电离是浓度越小,电离程度越大,所以C的电离程度最大
(3)醋酸是共价化合物,纯醋酸实际不存在离子,加入水后,醋酸电离生成氢离子,氢离子浓度自然增大,如果水加入的过多,离子浓度自然下降,所以浓度先增大后减小。

练习册系列答案
相关题目
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率为v (PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前v (正)>v (逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%