题目内容
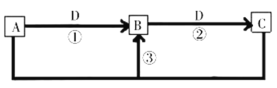
【题目】短周期主族元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们中的两种或三种元素间形成的化合物,Y元素的焰色反应呈黄色,Y、Z、Q的最高价氧化物对应水化物相互之间可反应。B是两性氢氧化物;D是由W与Q形成的化合物,常温下,![]() 溶液的pH为1。在一定条件下它们之间的相互转化关系如图所示。下列说法正确的是
溶液的pH为1。在一定条件下它们之间的相互转化关系如图所示。下列说法正确的是
A.可通过电解熔融的C得到Z单质
B.X元素的氢化物沸点比同主族元素的氢化物高
C.W、X、Y、Z元素的原子半径大小为![]()
D.A的水溶液呈弱碱性,是因为含有元素Y
【答案】B
【解析】
已知A、B、C、D是它们中的两种或三种元素间形成的化合物,Y元素的焰色反应呈黄色,Y为Na, Y、Z、Q的最高价氧化物对应水化物相互之间可反应,则Z应为Al,Q为非金属元素且其最高价氧化物水化物能溶解氢氧化铝且与氢氧化钠反应,则可能为S或者Cl,D是由W与Q形成的化合物,常温下,![]() 溶液的pH为1,则D应为一元强酸,因此Q应为Cl,B是两性氢氧化物则B为氢氧化铝,原子序数可知W为氢、X为氧,结合转化关系图,A可以与HCl反应产生氢氧化铝,则A应为偏铝酸钠,C为氯化铝,据此分析解答;
溶液的pH为1,则D应为一元强酸,因此Q应为Cl,B是两性氢氧化物则B为氢氧化铝,原子序数可知W为氢、X为氧,结合转化关系图,A可以与HCl反应产生氢氧化铝,则A应为偏铝酸钠,C为氯化铝,据此分析解答;
由以上分析可知W为H、X为O、Y为Na、Z为Al、Q为Cl,A为NaAlO2,B为Al(OH)3,C为AlCl3,D是HCl。
A.氯化铝是分子晶体,其熔融状态不导电,故不能通过电解其熔融物制取铝单质,工业上采用电解熔融氧化铝的方法制取铝,故A错误;
B.X的氢化物为水,水分子间存在氢键,导致其熔沸点在同族气态氢化物中最高,故B正确;
C.电子层数越多原子半径越大,电子层数相同时,核电荷数越大半径越大,因此原子半径Na>Al>O>H,故C错误;
D.A为偏铝酸钠,偏铝酸根水解使溶液显碱性,与钠离子无关,故D错误;
故选:B。