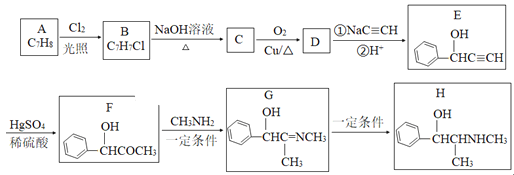
题目内容
【题目】短周期元素的离子![]() 、
、![]() 、
、![]() 、
、![]() 都具有相同的电子层结构,下列关系正确的是( )
都具有相同的电子层结构,下列关系正确的是( )
A.离子的还原性:![]() ,质子数:
,质子数:![]()
B.氢化物的稳定性:![]()
C.第一电离能:![]() ,原子半径:
,原子半径:![]()
D.电负性:![]()
【答案】D
【解析】
元素周期表前三周期元素的离子![]() 、
、![]() 、
、![]() 、
、![]() 具有相同电子层结构,核外电子数相等,所以
具有相同电子层结构,核外电子数相等,所以![]() ,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素。
,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素。
A.由以上分析可知![]() ,
,![]() ,则质子数
,则质子数![]() ,非金属性
,非金属性![]() ,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性
,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性![]() ,故A错误;
,故A错误;
B.非金属性![]() ,非金属性越强氢化物越稳定性,氢化物稳定性为
,非金属性越强氢化物越稳定性,氢化物稳定性为![]() ,故B错误;
,故B错误;
C.W为Al元素,X为Na元素,同周期随原子序数增大原子半径减小、第一电离能呈增大趋势,故原子半径![]() ,第一电离能
,第一电离能![]() ,故C错误;
,故C错误;
D.同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性:![]() ,故D正确;
,故D正确;
答案选D。

练习册系列答案
相关题目
【题目】有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
容器 | 起始时 | ||
t/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
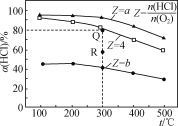
A. ΔH<0,a<4<b
B. 300℃该反应的平衡常数的值为64
C. 容器Ⅲ某时刻处在R点,则R点的υ正>υ逆,压强:p(R)>p(Q)
D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·L-1