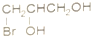
题目内容
3.能正确解释下列反应原理的离子方程式是( )| A. | 用NaOH溶液吸收多余的氯气:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | Fe粉加入稀盐酸中制取氢气:2 Fe+6 H+═2 Fe3++3 H2↑ | |
| D. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO42-═BaSO4↓ |
分析 A.反应生成氯化钠、次氯酸钠和水;
B.小苏打为碳酸氢钠;
C.反应生成氯化亚铁和氢气;
D.漏写生成水的离子反应.
解答 解:A.用NaOH溶液吸收多余的氯气的离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故A正确;
B.用小苏打治疗胃酸过多的离子反应为HCO3-+H+═CO2↑+H2O,故B错误;
C.Fe粉加入稀盐酸中制取氢气的离子反应为Fe+2H+═Fe2++H2↑,故C错误;
D.氢氧化钡溶液与稀硫酸混合的离子反应为2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O,故D错误;
故选A.
点评 本题考查离子反方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应及氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
20.现有6种无色溶液:乙醇、苯酚、甲苯、硝酸银、氢氧化钾、硫化氢,能将他们一一区分开的试剂是( )
| A. | 新制氢氧化铜悬浊液 | B. | 氯化铁溶液 | ||
| C. | 氯化钡溶液 | D. | 酸性高锰酸钾溶液 |
1.下列说法正确的是( )
| A. | 可用如图所示装置作为实验室制取乙烯的发生装置 | |
| B. | 乙烯与酒精蒸汽按任意物质的量比混合,取VL该气体完全燃烧,相同条件消耗O2体积为3VL | |
| C. | 乙烯、乙醇都能使酸性高锰酸钾溶液褪色,符合通式CnH2n和CnH2n+2O的物质也都能使酸性高锰酸钾溶液褪色 | |
| D. | 甲苯在光照条件和 FeBr3作用下都能与Br2反应,反应产物相同 |
11.下列各组粒子中,所含化学键类型有差异的是( )
| A. | CCl4 和CH2Cl2 | B. | H3O+ 和NH4+ | C. | CaO2 和 CaF2 | D. | Ba(0H)2 和NaOH |
18.具有下列电子层结构的原子,其相应元素一定属于同一主族的是( )
| A. | 3p轨道上有2个未成对电子的原子和4p轨道上有2个未成对电子的原子 | |
| B. | 3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子 | |
| C. | 最外层电子排布为1s2的原子和最外层电子排布为2s22p6的原子 | |
| D. | 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 |
8.改变反应物的用量,下列反应不能用同一个反应方程式表示的是( )
①NaAlO2溶液与CO2反应; ②Si与烧碱溶液反应; ③H2S与NaOH溶液反应;
④Fe与稀硝酸反应; ⑤S在O2中燃烧; ⑥C与O2的反应.
①NaAlO2溶液与CO2反应; ②Si与烧碱溶液反应; ③H2S与NaOH溶液反应;
④Fe与稀硝酸反应; ⑤S在O2中燃烧; ⑥C与O2的反应.
| A. | ①②③⑤ | B. | ①③④ | C. | ①③④⑥ | D. | ①③④⑤⑥ |
15. 如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )
如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )
 如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )
如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )| A. | A是Zn,B是Cu,C是稀硫酸 | B. | A是Cu,B是Zn,C是稀硫酸 | ||
| C. | A是Fe,B是Ag,C是AgNO3稀溶液 | D. | A是Ag,B是Fe,C是AgNO3稀溶液 |
12.设NA为阿伏加德罗常数的值,标准状况下O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积应是( )
| A. | $\frac{22.4nb}{m{N}_{A}}$L | B. | $\frac{22.4mb}{n{N}_{A}}$ L | C. | $\frac{22.4n{N}_{A}}{mb}$ L | D. | $\frac{nb{N}_{A}}{22.4m}$ L |


 .
. B、
B、 C、
C、 D、
D、