题目内容
【题目】下列离子方程式书写正确的是( )
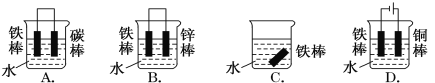
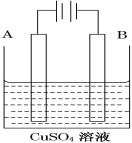
A.用石墨作阴极、铜作阳极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3 ↓+NH3·H2O
C.含0.1 mol FeI2的溶液中滴加含0.1 mol Cl2的氯水:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.酸性KMnO4溶液与双氧水反应:2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O
【答案】B
【解析】
A. 铜作阳极电解饱和食盐水时,阳极上Cu放电,Cl-不放电;
B. 0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合,生成硫酸钡和氢氧化铝沉淀及NH3·H2O;
C. 还原性I->Fe2+,据此判断发生的反应;
D. 电荷不守恒。
A. 铜作阳极电解饱和食盐水时,阳极上Cu放电,反应生成氢氧化铜和氢气,反应为:Cu+2H2O![]() Cu(OH)2↓+H2↑,A项错误;
Cu(OH)2↓+H2↑,A项错误;
B. 0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合,生成硫酸钡和氢氧化铝沉淀及NH3·H2O,离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3 ↓+NH3·H2O,B项正确;
C. 还原性I->Fe2+,因此Cl2先氧化I-,当所有的I-都被氧化后再氧化Fe2+,向含0.1 molFeI2的溶液中滴加含0.1 mol Cl2的氯水,只有I-被氧化,因此离子方程式为:2I-+Cl2=I2+2Cl-,C项错误;
D. 酸性KMnO4溶液与双氧水反应,离子方程式为:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O,D项错误;
答案选B。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()