题目内容
 在全球一致倡导低碳经济的大背景下,对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响.
在全球一致倡导低碳经济的大背景下,对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响.(1)以CO和O2为电极燃料,以KOH溶液为电解质组成燃料电池,请写出该电池的负极反应式
(2)25℃时,1mol 石墨和1mol CO完全燃烧放出热量分别为393.5kJ、283.0kJ.请写出石墨不完全燃烧时的热化学方程式
(3)25℃时,反应2CO2(g)?2CO(g)+O2(g)的平衡常数K=1.72×10-46.在一个体积可变的密闭容器中充入一定量CO2、CO、O2的混合气体,以下说法正确的是
A.要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是[c(CO)?c(O2)]/c(CO2)<1.72×10-46
B.达平衡后,其他条件不变时,升高温度或增加容器的压强,平衡均逆向移动
C.平衡常数K随温度的升高而增大
D.平衡常数K随压强的增大而减小
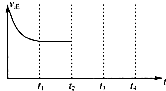
(4)25℃时,在一个保持恒温恒容的密闭容器中充入一定量CO2、CO、O2的混合气体,从起始到t1时刻达到平衡状态,速率变化如图所示.在t2时刻再加入一定量的CO2后于t3时刻达到新的平衡,请画出t2~t3的速率变化图(需标出v正,v逆).
考点:常见化学电源的种类及其工作原理,热化学方程式,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)碱性条件下,CO失电子生成CO32-;
(2)根据已知反应的热化学方程式结合盖斯定律分析;
(3)A.当
>1.72×10-46,平衡正移;
B.根据温度和压强对平衡的影响分析;
C.根据温度对平衡的影响分析;
D.根据压强对K的影响分析;
(4)在t2时刻再加入一定量的CO2后正反应速率瞬间增大,然后逐渐减小,逆反应速率逐渐增大.
(2)根据已知反应的热化学方程式结合盖斯定律分析;
(3)A.当
| c(CO)?c(O2) |
| c(CO2) |
B.根据温度和压强对平衡的影响分析;
C.根据温度对平衡的影响分析;
D.根据压强对K的影响分析;
(4)在t2时刻再加入一定量的CO2后正反应速率瞬间增大,然后逐渐减小,逆反应速率逐渐增大.
解答:
解:(1)碱性条件下,燃料电池的负极上CO失电子生成CO32-,起电极反应式为:CO-2e-+4OH-═CO32-+2H2O;
故答案为:CO-2e-+4OH-═CO32-+2H2O;
(2)25℃时,1mol 石墨和1mol CO完全燃烧放出热量分别为393.5kJ、283.0kJ,
则①C(石墨,s)+O2(g)=CO2(g)△H=-393.5kJ/mol,
②CO(g)+
O2(g)=CO2(g)△H=-283.0kJ/mol
根据盖斯定律①-②得:C(石墨,s)+
O2(g)═CO(g);△H=-110.5 kJ/mol;
故答案为:C(石墨,s)+
O2(g)═CO(g);△H=-110.5 kJ/mol;
(3)A.当
>1.72×10-46,平衡正移,所以要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是
>1.72×10-46,故A错误;
B.该反应为分解反应正方向为吸热反应,所以升高温度平衡正移,该反应正方向为体积增大的方向,所以增大压强平衡逆移,故B错误;
C.该反应为分解反应正方向为吸热反应,所以升高温度平衡正移,K增大,故C正确;
D.平衡常数K只随温度的变化而变化,所以增大压强平衡常数不变,故D错误;
故答案为:C;
(4)25℃时,在一个保持恒温恒容的密闭容器中充入一定量CO2、CO、O2的混合气体,从起始到t1时刻达到平衡状态,速率变化如图所示.在t2时刻再加入一定量的CO2后正反应速率瞬间增大,然后逐渐减小,逆反应速率逐渐增大,于t3时刻达到新的平衡,依此作图为: ;
;
故答案为: .
.
故答案为:CO-2e-+4OH-═CO32-+2H2O;
(2)25℃时,1mol 石墨和1mol CO完全燃烧放出热量分别为393.5kJ、283.0kJ,
则①C(石墨,s)+O2(g)=CO2(g)△H=-393.5kJ/mol,
②CO(g)+
| 1 |
| 2 |
根据盖斯定律①-②得:C(石墨,s)+
| 1 |
| 2 |
故答案为:C(石墨,s)+
| 1 |
| 2 |
(3)A.当
| c(CO)?c(O2) |
| c(CO2) |
| c(CO)?c(O2) |
| c(CO2) |
B.该反应为分解反应正方向为吸热反应,所以升高温度平衡正移,该反应正方向为体积增大的方向,所以增大压强平衡逆移,故B错误;
C.该反应为分解反应正方向为吸热反应,所以升高温度平衡正移,K增大,故C正确;
D.平衡常数K只随温度的变化而变化,所以增大压强平衡常数不变,故D错误;
故答案为:C;
(4)25℃时,在一个保持恒温恒容的密闭容器中充入一定量CO2、CO、O2的混合气体,从起始到t1时刻达到平衡状态,速率变化如图所示.在t2时刻再加入一定量的CO2后正反应速率瞬间增大,然后逐渐减小,逆反应速率逐渐增大,于t3时刻达到新的平衡,依此作图为:
 ;
;故答案为:
 .
.
点评:本题考查了燃料电池的电极方程式的书写、盖斯定律的应用、平衡移动、反应速率图象等,考查的知识点较多,侧重于考查学生的综合能力,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法不正确的是( )
| A、2013年1月1日起,我省正式发布环境空气质量指数(AQI),包括PM2.5、PM10、O3、CO2、SO2和NO2等6项指标 |
| B、核磁共振仪、红外光谱仪、紫外光谱仪、质谱仪等都可用于有机化合物结构的分析 |
| C、石油裂解、海水制镁、纯碱晶体风化、纤维素制火棉等过程中都包含化学变化 |
| D、维勒打破了无机物和有机物的界限,卢瑟福提出了带核的原子结构模型 |
设NA为阿伏加德罗常数的值,则下列说法正确的是( )
| A、常温下,0.1 mol碳酸钠晶体中含有CO32-的数目小于0.1 NA |
| B、36g CaO2中含有的离子数目为0.15 NA |
| C、100g 98%的浓硫酸中,氧原子总数为4NA |
| D、标准状况下,14.2g氯气与足量石灰乳充分反应转移电子数为0.2NA |
下列表达不正确的是( )
| A、NaHS在水中的电离方程式为:NaHS═Na++HS-和HS-═H++S2- |
| B、同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3?H2O)>V(HCl) |
| C、Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-) |
| D、同浓度的下列溶液中,c(CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH |
 2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾履形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾履形成的原因. 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.