题目内容
3. 铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).(1)Cu+基态的电子排布式可表示为[Ar]3d10.
(2)1mol甲醛(HCHO)中含有的σ键数目为3NA.
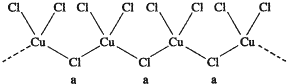
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为sp3.这两种不同化合物的化学式分别为K2CuCl3、KCuCl3.
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应生成铜氨离子Cu(NH3)42+,①反应的离子方程式为Cu+H2O2+4NH3=[Cu(NH3)4]2++2OH-;②[Cu(NH3)4]2+中存在的化学键类型有A、C(填序号).
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
(5)金属铍与氯气也可以形成化合物,在气态二氯化铍中有单体BeCl2和二聚体(BeCl2)2:在晶体中变形成多聚体(BeCl2).试画出各种存在形式的结构式,并指出对应Be原子的杂化轨道类型.
结构式Cl-Be-Cl杂化轨道类型sp
结构式
 杂化轨道类型sp2
杂化轨道类型sp2结构式
 杂化轨道类型sp3.
杂化轨道类型sp3.
分析 (1)Cu的原子序数为29;
(2)HCHO中存在2个C-H和1和C=O键;
(3)a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,据此判断;一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,CuCl3原子团的化合价为-2,据此书写;
(4)氨水和过氧化氢的混合溶液反应生成铜氨离子Cu(NH3)42+,Cu(NH3)42+中含共价键、配位键;
(5)可能存在三种结构,分别为Cl-Be-Cl、 、
、 ,以此来解答.
,以此来解答.
解答 解:(1)Cu的原子序数为29,Cu+基态的电子排布式可表示为[Ar]3d10,故答案为:[Ar]3d10;
(2)HCHO中存在2个C-H和1和C=O键,则1mol甲醛(HCHO)中含有的σ键数目为3NA,故答案为:3NA;
(3)a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,杂化轨道类型为:sp3,
一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,CuCl3原子团的化合价为-2,其化学式为:K2CuCl3,
故答案为:sp3;K2CuCl3;KCuCl3;
(4)①氨水和、Cu、过氧化氢的混合溶液反应生成铜氨离子,离子反应物为Cu+H2O2+4NH3=[Cu(NH3)4]2++2OH-;
故答案为:Cu+H2O2+4NH3=[Cu(NH3)4]2++2OH-;
②Cu(NH3)42+含N-H极性共价键、配位键,故答案为:A、C;
(5)气态二氯化铍中有单体BeCl2和二聚体(BeCl2)2,结构为Cl-Be-Cl,形成2个σ键,Be杂化为sp杂化;
结构为 ,形成3个σ键,Be杂化为sp2杂化;
,形成3个σ键,Be杂化为sp2杂化;
结构为 ,形成4个σ键,Be杂化为sp3杂化,
,形成4个σ键,Be杂化为sp3杂化,
故答案为:Cl-Be-Cl;sp; ;sp2;
;sp2; ;sp3.
;sp3.
点评 本题考查配合物成键及杂化理论等,为高频考点,把握物质结构与性质、杂化等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 1085℃ | B. | 1160℃ | C. | 1200℃ | D. | 1535℃ |
| A. | X只能是第三周期元素 | B. | a-b+n+m的和只可能等于10 | ||
| C. | b大于5 | D. | Y可能是第二周期元素 |
| A. | 2H++2e-═H2 | B. | Fe-2e-═Fe2+ | ||
| C. | 2H2O+O2+4e-═4OH- | D. | Fe+2e-═Fe2+ |
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、NO3-、CO32- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | H+,K+,OH-,NO3- |
| A. | 2个-CH3,能生成4种一氯代物 | B. | 3个-CH3,能生成4种一氯代物 | ||
| C. | 3个-CH3,能生成5种一氯代物 | D. | 4个-CH3,能生成4种一氯代物 |
 .
.