题目内容
3. H2C2O4为二元弱酸.20℃时,向0.100mol•L-1的H2C2O4溶液中逐量加入NaOH固体(不考虑溶液体积变化),溶液中部分微粒的物质的量浓度随pH的变化如图所示.则下列指定溶液中微粒物质的量浓度的关系一定正确的是( )
H2C2O4为二元弱酸.20℃时,向0.100mol•L-1的H2C2O4溶液中逐量加入NaOH固体(不考虑溶液体积变化),溶液中部分微粒的物质的量浓度随pH的变化如图所示.则下列指定溶液中微粒物质的量浓度的关系一定正确的是( )| A. | Na2C2O4溶液中:2c(C2O42-)>c(Na+) | |
| B. | pH=5的溶液中:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100mol•L-1+c(HC2O4-) | |
| D. | c(Na+)=0.100mol•L-1的溶液中:c(H+)-c(OH-)=c(C2O42-)-c(H2C2O4) |
分析 20℃时,向0.100mol/L的H2C2O4溶液中逐量加入NaOH固体(不考虑溶液体积变化),发生的反应为:H2C2O4+OH-═HC2O4-+H2O,HC2O4-+OH-═C2O42-+H2O,图象反应的是平衡浓度的变化,结合溶液中的守恒思想,据此分析判断.
解答 解:20℃时,向0.100mol/L的H2C2O4溶液中逐量加入NaOH固体(不考虑溶液体积变化),发生的反应为:H2C2O4+OH-═HC2O4-+H2O,HC2O4-+OH-═C2O42-+H2O,图象反应的是平衡浓度的变化,
A.Na2C2O4溶液中,Na2C2O4水解使溶液显碱性,溶液中c(H+)<c(OH-),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),由于c(H+)<c(OH-),则c(Na+)>c(HC2O4-)+2c(C2O42-),因此2c(C2O42-)<c(Na+),故A错误;
B.pH=5的溶液中,大量存在C2O42-,根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故B错误;
C.c(HC2O4-)=c(C2O42-)的溶液,根据物料守恒,c(HC2O4-)+c(C2O42-)=0.1mol/L,若溶液pH为中性,根据电荷守恒可以得到:c(Na+)=c(HC2O4-)+2c(C2O42-),则c(Na+)=0.100mol/L+c(HC2O4-),但此时溶液呈酸性,则c(Na+)<0.100mol/L+c(HC2O4-),故C错误;
D.c(Na+)=0.100mol/L的溶液中,表明此时溶液恰好存在NaHC2O4,根据质子守恒,c(H2C2O4)+c(H+)=c(C2O42-)+c(OH-),即c(H+)-c(OH-)=c(C2O42-)-c(H2C2O4),故D正确.
故选D.
点评 本题考查酸碱滴定原理,结合图象分析,注意图象反应的是溶液中各组分平衡浓度的变化情况,牢牢把握溶液中的守恒思想是解题的关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 | |
| B. | 等质量的硫蒸气和固态硫单质分别完全燃烧,后者放出的热量多 | |
| C. | 表示氢气燃烧热的△H为-285.8 kJ•mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | 已知中和热△H为-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
| A. | 煅烧石灰石 | B. | 锌与稀硫酸反应 | ||
| C. | NaOH溶液和稀盐酸反应 | D. | 铝热反应 |
| A. | CCl4的电子式: | B. | 中子数为8的碳原子:${\;}_{6}^{14}$C | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | CH4分子的比例模型: |

| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能与溴的单质发生加成反应 | |
| C. | 甲、乙都能与金属钠反应生成氢气 | |
| D. | 一定条件下,甲、乙均能发生取代反应 |
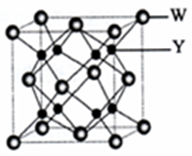 有X、Y、Z、W、A、B六种元素.其相关信息如下:
有X、Y、Z、W、A、B六种元素.其相关信息如下:请回答下列有关问题:
| 元素 | 相关信息 | ||||||||||||||
| X | X原子的1s轨道上只有1个电子 | ||||||||||||||
| Y | Y是周期表中电负性最大的元素 | ||||||||||||||
| Z | Z是第三周期主族元素,其电离能l1~l7如下表所示(单位:KJ/mol)
| ||||||||||||||
| W | W是主族元素且与A同周期,其最外电子层上有两个运动状态不同的电子 | ||||||||||||||
| A | A是过渡元素,其基态原子的外围电子排布图为: | ||||||||||||||
| B | B元素基态原子的2p轨道中有三个未成对的电子 |
(2)BX3分子的中心原子采取的杂化类型是sp3.
(3)光谱证实单质 Z与强碱溶液反应生成[Z(OH)4]-,该原子的空间构型是正四面体型,[Z(OH)4]-离子中存在的化学键有ACD (填字母)
A.极性共价键 B.非极性共价键 C.配位键 D.σ键 E.π键
(4)Y与W可形成离子化合物,其晶胞结构如下图所示.W离子采取的堆枳方式是面心立方堆积,W离子的配位数为8,W离子的配位数为此空多余,Y离子占据空位四面体(填“四面体或八面体”).若该晶体的密度为dg•cm-3,则该晶胞中最近的Y离子与W离子间的距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{{N}_{A}×d}}$cm,(设NA为阿佛加德罗常数的值,只需列出计算表达式)
| A. | 水解反应 | B. | 氧化反应 | C. | 酯化反应 | D. | 加成反应 |
| A. | 形成离子键的阴、阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
 ;
;  ;
; ;
;  .
.