题目内容
某石油液化气由丙烷和丁烷组成,其质量分数分别为80%和20%。已知:
C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(g) ΔH=-2200kJ·mol-1
3CO2(g)+4H2O(g) ΔH=-2200kJ·mol-1
2C4H10(g)+13O2(g)![]() 8CO2(g)+10H2O(g) ΔH=-5800kJ·mol-1
8CO2(g)+10H2O(g) ΔH=-5800kJ·mol-1
现有一质量为0.80kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗0.056kg石油液化气,试计算该燃料的利用率。已知水的比热容为4.2kJ·kg-1·℃-1,铝的比热容为0.88kJ·kg-1·℃-1。
50%
解析:
本题把物理学中的热学知识与化学中的反应热结合在一起考查,应用能量守恒原理即可解决。
由热化学方程式可知,C3H8的燃烧热为2 200 kJ· mol-1,C4H10的燃烧热为2 900 kJ· mol-1,故可先计算液化气燃烧放出的热量。
![]()
再根据物理学知识计算:
Q吸=mcΔt=[4.0L×1kg·L-1×4.2kJ·kg-1·℃-1+0.80kg×0.88kJ·(kg·℃)-1]×(100℃-20 ℃)=1400kJ。
![]()

练习册系列答案
相关题目
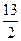 O2(g)==4CO2(g)+5H2O(1) △H=-2 900 kJ/mol
O2(g)==4CO2(g)+5H2O(1) △H=-2 900 kJ/mol