题目内容
11. 下列各组物质中,物质之间通过一步反应,能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应,能实现如图所示转化的是( )| a | b | c | |
| A | Cl2 | HClO | HCl |
| B | Si | SiO2 | H2SiO3 |
| C | Cu | CuSO4 | Cu(OH)2 |
| D | Na | NaOH | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯气和水反应生成HClO,HClO分解生成HCl,HCl被氧化可生成氯气;
B.二氧化硅不能直接生成硅酸;
C.氢氧化铜不能直接生成铜;
D.碳酸氢钠不能直接生成钠.
解答 解:A.氯气和水反应生成HClO,HClO分解生成HCl,HCl被氧化可生成氯气,可通过一步反应生成,故A正确;
B.SiO2→H2SiO3必须经过两步:SiO2+2NaOH→Na2SiO3+H2O和Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3,故B错误;
C.氢氧化铜应先分解生成氧化铜,氧化铜与还原剂反应生成铜,故C错误
D.一般用电解熔融的氯化钠的方法冶炼钠,碳酸氢钠不能直接生成钠,故D错误.
故选A.
点评 本题考查了元素化合物的性质,题目难度不大,侧重对学生基础知识的检验和训练,同时坚固对学生能力的培养,有利于激发学生的学习积极性,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
19.铁铝矾[Al2Fe(SO4)4•xH2O]有净水作用,将其溶于水中得到浅绿色溶液,有关该溶液的叙述正确的是( )
| A. | 该溶液显中性 | |
| B. | 该溶液中:2 c(Al3+)+c(Fe2+)+c(H+ )=4 c(SO42-)+c(OH-) | |
| C. | 在空气中蒸干并灼烧该溶液,最后所得的残留固体为Al2O3、Fe2O3 | |
| D. | 向该溶液中加入Ba(OH)2溶液,当SO42-完全沉淀时,Al3+、Fe2+恰好被完全沉淀 |
2.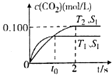 汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
(1)该反应为放热(填“放热”或“吸热”)反应,在T2温度下,0~2s内的平均反应速率v(N2)=0.05mol/(L•s).
(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,请画出在T1、S2条件下反应达到平衡过程中c(CO2)的变化曲线.
(3)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
①T3时该反应的平衡常数K=0.5,若起始时向容器Ⅰ中充入1.0mol NO,1.5mol CO和2.0molCO2,0.5molN2,则反应向逆(填“正”或“逆”)反应方向进行.
②平衡时两容器中CO的转化率:Ⅰ<Ⅱ(填“>”、“<”或“=”);容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为增加NO量或较低温度或增大压强(答一条即可).
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是BD(填序号).(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)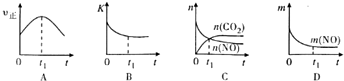
(5)有人设想按反应:2CO(g)=2C(s)+O2(g)来除去尾气中的CO,简述该设想能否实现△H>0、△S<0,则在任何温度下△G>0,不可能自发进行.
 汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:(1)该反应为放热(填“放热”或“吸热”)反应,在T2温度下,0~2s内的平均反应速率v(N2)=0.05mol/(L•s).
(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,请画出在T1、S2条件下反应达到平衡过程中c(CO2)的变化曲线.
(3)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
| 容器编号 | 起始物质的量 | 平衡时物质的量 |
| Ⅰ | 2.0mol NO,2.0mol CO | 1.0mol CO2 |
| Ⅱ | 4.0mol NO,4.0mol CO |
②平衡时两容器中CO的转化率:Ⅰ<Ⅱ(填“>”、“<”或“=”);容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为增加NO量或较低温度或增大压强(答一条即可).
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是BD(填序号).(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)

(5)有人设想按反应:2CO(g)=2C(s)+O2(g)来除去尾气中的CO,简述该设想能否实现△H>0、△S<0,则在任何温度下△G>0,不可能自发进行.
6.钓鱼岛群岛的东海海域及部分太平洋海域探明为海底热水矿床.海底热水矿床是沉积着由岩浆热气从地底喷出的金、铜、锌、稀有金属等区域.下列说法正确的是( )
| A. | 金不溶于任何溶液 | |
| B. | 铜、锌在空气中均能被氧化成对应的氧化物 | |
| C. | 铜锌合金的熔点低于铜或锌的熔点 | |
| D. | ${\;}_{29}^{63}$Cu的质子数和中子数之差为34 |
16.镁铝性质相似,下表中对两者的对比不正确的是( )
| 选项 | 反应 | 铝 | 镁 |
| A | 与非金属 | 能被Cl2、O2氧化 | 能与N2、O2反应 |
| B | 与水 | 能与沸水反应 | 反应很困难 |
| C | 与碱 | 能溶于强碱溶液 | 不反应 |
| D | 与某些氧化物 | 能与Fe2O3、MnO2、Cr2O3等 金属氧化物发生铝热反应 | 能在CO2中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
3.下列化学用语的书写正确的是( )
| A. | 氮气的电子式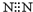 | B. | 乙烯的结构式:C2H4 | ||
| C. | 用电子式表示HCl的形成过程: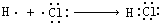 | D. | 乙醇的分子式:C2H5OH |
20.分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )
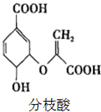

| A. | 分枝酸的分子式为C10H8O6 | |
| B. | 分枝酸能发生取代、加成、氧化反应 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 1mol分枝酸最多可与2molBr2发生反应 |
1.下列措施对增大反应速率明显有效的是( )
| A. | 在H202分解中加入MnO2 | |
| B. | Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸 | |
| C. | 在NaOH与HCL两溶液反应时,增大压强 | |
| D. | Na与水反应时增大水的用量 |