题目内容
将Q和R加入到密闭体系中,在一定条件下发生反应3Q(s)+R(g)═2W(g).平衡时W的体积分数随温度和压强的变化如下表所示:下列说法正确的是( )
| 1 MPa | 2 MPa | 3 MPa | |
| 500℃ | 45.3% | ||
| 700℃ | a | 66.7% | |
| 900℃ | 73.6% |
| A、该反应的△H<0 |
| B、45.3%<a<66.7% |
| C、该反应的平衡常数K(900℃)>K(700℃) |
| D、700℃、2 MPa时R的转化率为50% |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、相同压强下,温度越高,W含量越高,升温平衡正向移动,即正反应为吸热反应;
B、同温下,增大压强,平衡逆向进行,平衡时W的体积分数变小,故可知a>66.7%;
C、正反应吸热,平衡常数随温度的升高而增大;
D、在700℃、2.0MPa下,设R的起始量为amol,转化率为x,则平衡时W的量为2ax,由题意得
=66.7%,解得x=0.5.
B、同温下,增大压强,平衡逆向进行,平衡时W的体积分数变小,故可知a>66.7%;
C、正反应吸热,平衡常数随温度的升高而增大;
D、在700℃、2.0MPa下,设R的起始量为amol,转化率为x,则平衡时W的量为2ax,由题意得
| 2ax |
| a-ax+2ax |
解答:
解:A、温度越高,生成物W含量越高,升温平衡正向移动,即正反应为吸热反应该反应△H>0,故A错误;
B、正反应气体体积增大,相同温度下,压强增大时平衡逆向移动,生成物W的体积分数随压强的增大而减小,所以a>66.7%,故B错误;
C、该反应正反应吸热,平衡常数随温度的升高而增大,平衡常数K(900℃)>K(700℃),故C正确;
D、在700℃、2.0MPa下,设R的起始量为amol,转化率为x,则平衡时W的量为2ax,由题意得
=66.7%,解得x=0.5,故D正确;
故选CD.
B、正反应气体体积增大,相同温度下,压强增大时平衡逆向移动,生成物W的体积分数随压强的增大而减小,所以a>66.7%,故B错误;
C、该反应正反应吸热,平衡常数随温度的升高而增大,平衡常数K(900℃)>K(700℃),故C正确;
D、在700℃、2.0MPa下,设R的起始量为amol,转化率为x,则平衡时W的量为2ax,由题意得
| 2ax |
| a-ax+2ax |
故选CD.
点评:本题考查化学平衡影响因素分析,数据处理的方法应用,平衡计算和对比判断是解题关键,题目难度中等.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
下列物质中,既含有离子键又含有共价键的是( )
| A、氯化钠 | B、氢氧化钠 |
| C、水 | D、氯气 |
关于“摩尔”叙述正确的是( )
| A、摩尔是国际科学界建议采用的一种物理量 |
| B、摩尔可以把物质的宏观数量与微观粒子的数量联系起来 |
| C、摩尔是物质的量的单位,简称摩,符号为mol |
| D、国际上规定,0.012kg碳原子所含有的碳原子数目为1摩尔 |
下列物质中属于混合物的是( )
①五水硫酸铜 ②液氧 ③干冰 ④稀盐酸 ⑤氢氧化铁胶体 ⑥乙醇⑦洁净的矿泉水.
①五水硫酸铜 ②液氧 ③干冰 ④稀盐酸 ⑤氢氧化铁胶体 ⑥乙醇⑦洁净的矿泉水.
| A、①②⑤⑦ | B、④⑤⑦ |
| C、③④⑥ | D、⑤⑥⑦ |
下列化学用语正确的是( )
A、硝基苯的结构简式是 |
B、 乙烯的球棍模型 乙烯的球棍模型 |
C、丁烷的键线式  |
| D、CH3-CH=CH2的结构式CH3CHCH2 |
不能用排空气法收集的气体是( )
| A、02 |
| B、NH3 |
| C、H2 |
| D、NO |
下列关于有机物的认识正确的是( )
| A、C2H6与氯气发生取代反应、C2H4与HCl发生加成反应均可得到纯净的C2H5Cl |
| B、将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷 |
| C、乙烯结构中含有碳碳双键,苯中不含有碳碳双键,但两者均可以发生加成反应 |
| D、苯使酸性KMn04溶液、溴水都褪色,发生的都是氧化反应 |
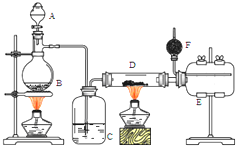 无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空:
无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空: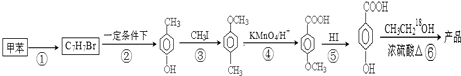
 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
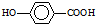
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 的同分异构体很多,其中符合下列条件有
的同分异构体很多,其中符合下列条件有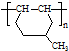 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图: