��Ŀ����
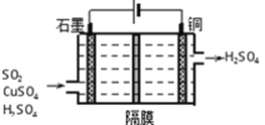
����Ŀ���ҹ��������������Ƶú�ʹ�ý���п�Ĺ��ң�һ������п��ZnS������SiO2������FeS��CdS��PbS���ʣ�Ϊԭ���Ʊ�����п��������ͼ��ʾ��
��ؽ�������[c0(Mn+)=0.1 mol��L-1]�γ��������������pH��Χ���£�
�������� | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
��ʼ������pH | 1.5 | 6.3 | 6.2 | 7.4 |
������ȫ��pH | 2.8 | 8.3 | 8.2 | 9.4 |
��ش��������⣺
��1�����չ����в��������廯ѧʽ__��
��2���ܽ�ʱ����߽����ʵķ�����____��������д�����֣�
��3������Fe(OH)3����Һ�뺬SO2��������Ӧ����FeSO4������ʹ�������÷�Ӧ�����ӷ���ʽΪ__������FeSO4�ڿ�������������������������÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ__��
��4����������ʱ������ZnO������ҺpH�����ù㷺pH��ֽ���pHֵΪ___ʱ������Ϊ�Ѵ����Ŀ�ġ�
A��2 B��2.8 C��4 D��6.2
��5������3�ɷ�Ϊ______��
��6��������п��ֱ�ӽ���ϡ���ᣬҪʹ0.10 molZnS��ȫ����1LH2SO4��������ӦZnS+H2SO4 =ZnSO4+H2S��������H2SO4�����Ũ��Ϊ___����Ksp[ZnS]��2.5��10��22��H2S��K1��1��10��7��K2��1��10��14�����Է�Ӧǰ��Һ������仯��
���𰸡�SO2 ���¡����顢���衢�������Ũ�ȡ��ӳ��ܽ�ʱ��� 2Fe(OH)3+SO2+2H+=2Fe2++SO42-+4H2O 1:4 C Cd��Zn 0.2 mol/L
��������
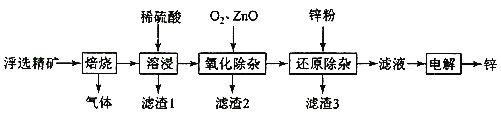
��п����ʱ��SԪ����������Ӧ���ɶ����������壻���ʱ���������������ᷴӦ������Ӧ���Σ�PbSO4���������費�����ᣬ������1ΪPbSO4���������裻��������ZnO����pH��ȥFeԪ�أ�����Zn�۳�ȥ��Һ�е�Cd2+���ӣ�
��1�����չ����н�����ת��Ϊ������������ΪSO2��
��2�������¶ȡ�������鼰�������Ũ�ȿɼӿ췴Ӧ���ʣ�����߽����ʵķ��������¡����顢���衢�������Ũ�ȡ��ӳ��ܽ�ʱ��ȡ�
��3��Fe(OH)3����ʱ��Fe(OH)3����Һ�뺬SO2��������Ӧ����FeSO4������2Fe(OH)3+ SO2+2H+=2Fe2++SO42-+4H2O��FeSO4�ڿ��������յĹ�������Ϊ��ԭ��FeSO4��Fe2+���ϼ�����1����������4�����ϼ�����������ȣ����������ͻ�ԭ�������ʵ���֮��Ϊ1:4��
��4������������ZnO����pH����2.8~6.2֮�䣬�����ǵ��㷺pH��ֽ�ľ���Ϊ��������ΪC��
��5����ԭ������������Һ�н��������ӻ���Cd2+��Zn2+��������ý���Zn�Ļ�ԭ���û�������Cd������п�۹���������3ΪCd��Zn��
��6���������⣬��0.10 mol ZnS��ȫ����1LH2SO4ʱ
ZnS + H2SO4 == ZnSO4 + H2S
0.10 0.10 0.10 0.10
��C(Zn2+)=0.10 mol/L��C(H2S)=0.10mol/L��C(S2)=Ksp(ZnS)/C(Zn2+)=2.5��10��21��K1 K2= C2 (H +)�� C(S2)/C(H2S)=1��10��21��C(H+)=0.20 mol/L��C(H2SO4 )=0.10+0.10=0.20mol/L��

 �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�����Ŀ�����ֶ�����Ԫ��A��B��C��D�����ʻ�ṹ��Ϣ���£�
��Ϣ����ԭ�Ӱ뾶��A<B<C<D��������Ԫ��֮���γɵ�ij���ַ��ӵı���ģ�ͼ������������£�
���� | ����ģ��ͼ | ���ڻ����� |
�� |
| �ǵ��������������֮һ���������������������Ҫ��Դ��Լռ�������ص�����֮�� |
�� |
| ��ɫ������ζ������ȼ���dz�����һ�ֻ�����Դ |
�� |
| ��ǿ�����Ե����ᣬ��Ư���ԣ�����������ɱ�� |
�����������Ϣ�ش��������⡣
��1��A��Ԫ�ط�����___��CԪ����Ԫ�����ڱ��е�λ����___���ĵ���ʽ��___��
��2��������DԪ�صĵ��������ʼ�Ӧ�õ����÷�Ӧ�����ӷ���ʽ��___��D���������У�EԪ�صĵ��ʻ�ԭ����ǿ����E�ĵ������Ӧ�����Һ��___���������������������ԣ��õ��뷽��ʽ��ʾ��ԭ����___��
��3����A��B��CԪ�ؿ���ɶ��ֻ������A��C��ɵ�һ�ֻ����ﶡ�������������������һ������ʯ�ͻ�����չˮƽ����ʵ�����п�������ȥ����������������___��
��A��C��ɵĻ������У���ѧʽΪC2A6����������D�ĵ��ʷ�����Ӧ������___��д������һ����ѧ����ʽ��___��
����Ŀ����������ʵ���������ó��Ľ��۲���ȷ����
ѡ�� | ʵ������ | ʵ����� |
A | ����Ƭ�ֱ�Ͷ��Ũ��ϡ�����У� ǰ�������������߷�Ӧ���� | ϡ����������Ա�Ũ�����ǿ |
B | ����з�̪��Na2CO3��Һ�� ����BaCl2��Һ����ɫ��dz | Na2CO3��Һ�д���ˮ��ƽ�� |
C | ij��Һ�еμӹ�����ˮ���� ��ɫ�����Ҳ��ܽ� | ����Һ�п��ܺ���Mg2+ |
D | ��ˮ��ͨ��SO2����ˮ��ɫ | SO2���л�ԭ�� |
A. AB. BC. CD. D