题目内容
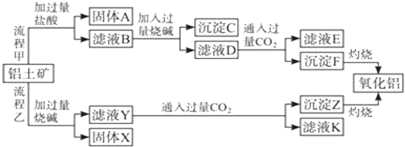
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题:
(1)向滤液Y中通入少量CO2时生成的沉淀只有F,发生反应的离子方程式为: ;判断OH-、SiO32-、AlO2-结合H+能力由强到弱的顺序为: .
(2)流程乙加入烧碱后生成SiO32-的离子方程式为 .
(3)欲检验滤液D中是否含有Fe3+,请写出检验该离子的实验操作: .
(4)滤液E、K中相同的溶质为 (填化学式),将该物质的溶液加入到偏铝酸钠溶液中生成白色沉淀,写出该反应的离子方程式 .

请回答下列问题:
(1)向滤液Y中通入少量CO2时生成的沉淀只有F,发生反应的离子方程式为:
(2)流程乙加入烧碱后生成SiO32-的离子方程式为
(3)欲检验滤液D中是否含有Fe3+,请写出检验该离子的实验操作:
(4)滤液E、K中相同的溶质为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:铝土矿主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质,向铝土矿中加入分离HCl,发生反应Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O、MgO+2HCl=MgCl2+H2O,SiO2和稀盐酸不反应,所以固体A是SiO2,滤液B中含有HCl、AlCl3、FeCl3、MgCl2,向滤液B中加入过量NaOH溶液,发生反应HCl+NaOH=NaCl+H2O、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O、MgCl2+2NaOH=Mg(OH)2↓+2NaCl、FeCl3+3NaOH=Fe(OH)3↓+3NaCl,所以沉淀C的成分是Mg(OH)2、Fe(OH)3,滤液D中含有NaCl、NaAlO2,向滤液D中通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,滤液E中成分是NaHCO3和NaCl,沉淀F是Al(OH)3,灼烧氢氧化铝得到Al2O3;
向铝土矿中加入过量NaOH溶液,二氧化硅和氧化铝都与NaOH溶液反应,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,所以利用Y中成分是NaAlO2、Na2SiO3,Fe2O3、MgO和NaOH溶液不反应,所以固体X是Fe2O3、MgO,向滤液Y中通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,则沉淀Z是H2SiO3,利用K是NaHCO3,灼烧氢氧化铝得到Al2O3,据此分析解答.
向铝土矿中加入过量NaOH溶液,二氧化硅和氧化铝都与NaOH溶液反应,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,所以利用Y中成分是NaAlO2、Na2SiO3,Fe2O3、MgO和NaOH溶液不反应,所以固体X是Fe2O3、MgO,向滤液Y中通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,则沉淀Z是H2SiO3,利用K是NaHCO3,灼烧氢氧化铝得到Al2O3,据此分析解答.
解答:
解:铝土矿主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质,向铝土矿中加入分离HCl,发生反应Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O、MgO+2HCl=MgCl2+H2O,SiO2和稀盐酸不反应,所以固体A是SiO2,滤液B中含有HCl、AlCl3、FeCl3、MgCl2,向滤液B中加入过量NaOH溶液,发生反应HCl+NaOH=NaCl+H2O、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O、MgCl2+2NaOH=Mg(OH)2↓+2NaCl、FeCl3+3NaOH=Fe(OH)3↓+3NaCl,所以沉淀C的成分是Mg(OH)2、Fe(OH)3,滤液D中含有NaCl、NaAlO2,向滤液D中通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,滤液E中成分是NaHCO3和NaCl,沉淀F是Al(OH)3,灼烧氢氧化铝得到Al2O3;
向铝土矿中加入过量NaOH溶液,二氧化硅和氧化铝都与NaOH溶液反应,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,所以利用Y中成分是NaAlO2、Na2SiO3,Fe2O3、MgO和NaOH溶液不反应,所以固体X是Fe2O3、MgO,向滤液Y中通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,则沉淀Z是H2SiO3,利用K是NaHCO3,灼烧氢氧化铝得到Al2O3,
(1)向滤液Y中通入少量CO2时生成的沉淀只有F,发生反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,电解质电离出氢离子越容易,则其相应的离子结合氢离子越难,电离出氢离子由强到弱的顺序是H2SiO3>HAlO2>H2O,则结合氢离子由强到弱的顺序为OH-、AlO2-、SiO32-,
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-; OH-、AlO2-、SiO32-;
(2)二氧化硅属于酸性氧化物,能和NaOH溶液反应生成硅酸钠和水,离子方程式为SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(3)铁离子和KSCN溶液反应生成络合物硫氰化铁,溶液呈血红色,其检验方法为取滤液D少许于试管中,向试管中滴加2滴KSCN溶液,若溶液变为红色说明滤液中含有Fe3+,若无明显变化则无Fe3+,故答案为:取滤液D少许于试管中,向试管中滴加2滴KSCN溶液,若溶液变为红色说明滤液中含有Fe3+,若无明显变化则无Fe3+;
(4)通过以上分析知,E、K中相同溶质为NaHCO3,碳酸氢钠和偏铝酸钠发生双水解反应生成氢氧化铝和碳酸钠,离子方程式为HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓,故答案为:NaHCO3; HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓.
向铝土矿中加入过量NaOH溶液,二氧化硅和氧化铝都与NaOH溶液反应,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,所以利用Y中成分是NaAlO2、Na2SiO3,Fe2O3、MgO和NaOH溶液不反应,所以固体X是Fe2O3、MgO,向滤液Y中通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,则沉淀Z是H2SiO3,利用K是NaHCO3,灼烧氢氧化铝得到Al2O3,
(1)向滤液Y中通入少量CO2时生成的沉淀只有F,发生反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,电解质电离出氢离子越容易,则其相应的离子结合氢离子越难,电离出氢离子由强到弱的顺序是H2SiO3>HAlO2>H2O,则结合氢离子由强到弱的顺序为OH-、AlO2-、SiO32-,
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-; OH-、AlO2-、SiO32-;
(2)二氧化硅属于酸性氧化物,能和NaOH溶液反应生成硅酸钠和水,离子方程式为SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(3)铁离子和KSCN溶液反应生成络合物硫氰化铁,溶液呈血红色,其检验方法为取滤液D少许于试管中,向试管中滴加2滴KSCN溶液,若溶液变为红色说明滤液中含有Fe3+,若无明显变化则无Fe3+,故答案为:取滤液D少许于试管中,向试管中滴加2滴KSCN溶液,若溶液变为红色说明滤液中含有Fe3+,若无明显变化则无Fe3+;
(4)通过以上分析知,E、K中相同溶质为NaHCO3,碳酸氢钠和偏铝酸钠发生双水解反应生成氢氧化铝和碳酸钠,离子方程式为HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓,故答案为:NaHCO3; HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓.
点评:本题考查混合物的分离和提纯,侧重考查学生分析问题能力、实验操作能力,能从整体上把握元素化合物知识,知道流程图中各个过程发生的反应,会正确书写相应的化学方程式及离子方程式,题目难度中等.

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
下列说法中错误的是( )
| A、化学反应必然伴随发生能量变化 |
| B、化学变化中的能量变化主要是由化学键变化引起的 |
| C、能量变化是化学反应的基本特征之一 |
| D、化学变化中能量变化的大小与反应物的质量的多少无关 |
下列各组中的两种溶液,不用其它试剂就可以鉴别开的是( )
①H3PO4,Ba(OH)2 ②FeCl3,NaOH ③NaOH,AlCl3 ④NaAlO2,HCl⑤AgNO3,氨水.
①H3PO4,Ba(OH)2 ②FeCl3,NaOH ③NaOH,AlCl3 ④NaAlO2,HCl⑤AgNO3,氨水.
| A、全部 | B、②③④ |
| C、②③ | D、③④⑤ |
将碘酒滴到切开的土豆片上,可观察到土豆片变蓝,说明土豆中含有( )
| A、油脂 | B、蛋白质 |
| C、淀粉 | D、纤维素 |