题目内容
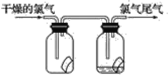
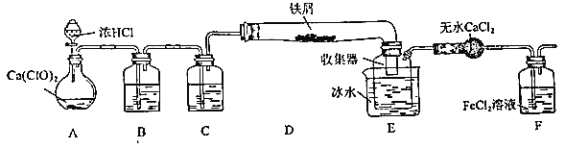
【题目】某学生欲在实验室制备无水 FeCl3 并得到副产物 FeCl3 溶液。经查阅资料得知:无水 FeCl3 在空气中易潮解,加热易升华。如图是他设计的实验装置图(加热及夹持装置略去)
完成下列填空:
(1)装置 A 是 Cl2 发生装置,其中的化学反应方程式为_____
(2)B 中的溶液是_____,C 的作用是_____
(3)D 加热后,少量生成 FeCl3 沉积在D 的右端,要使沉积的 FeCl3 进入E,操作是______________
E 中冰水的作用为_____
(4)实验员老师对上述装置提出了 2 点改进建议:一是装置连接部分都改成标准玻璃接口,不用橡胶连接件的原因是_____;二是这套装置还存在一个很大的缺陷,改进的方法是_______________
(5)证明 F中 FeCl2 未被完全氧化的方法是_____
【答案】![]() 饱和食盐水 干燥
饱和食盐水 干燥![]() 在沉积的
在沉积的![]() 固体下方加热 冷凝,使
固体下方加热 冷凝,使![]() 沉积 氯气会腐蚀橡胶连接件 在最后接上盛有NaOH溶液的洗气瓶(增加用NaOH溶液吸收尾气的装置) 取样,滴入1~2滴酸性
沉积 氯气会腐蚀橡胶连接件 在最后接上盛有NaOH溶液的洗气瓶(增加用NaOH溶液吸收尾气的装置) 取样,滴入1~2滴酸性![]() 溶液,溶液不显红色
溶液,溶液不显红色
【解析】
根据实验装置分析可知,A为浓盐酸和Ca(ClO)2发生氧化还原反应制取Cl2的装置,B为吸收挥发的HCl气体的装置,C为干燥装置,D为Cl2和铁屑发生反应2Fe+3Cl2![]() 2FeCl3制备无水FeCl3的装置,E为沉积装置,Cl2经无水CaCl2干燥后进入F装置中氧化FeCl2溶液制得FeCl3溶液,据此分析解答。
2FeCl3制备无水FeCl3的装置,E为沉积装置,Cl2经无水CaCl2干燥后进入F装置中氧化FeCl2溶液制得FeCl3溶液,据此分析解答。
(1)根据上述分析可知,A装置中浓盐酸和Ca(ClO)2发生氧化还原反应制取Cl2,同时生成CaCl2和H2O,则发生反应方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)由于浓HCl易挥发,因此制得的Cl2中含有少量的HCl气体,可用饱和食盐水除去,由题干信息可知,无水FeCl3在空气中易潮解,因此Cl2需干燥后再进入D装置中与铁屑发生反应制得无水FeCl3,则C装置的作用为干燥Cl2,故答案为:饱和食盐水;干燥Cl2;
(3)D加热后,少量生成FeCl3沉积在D的右端,由题干信息可知,无水FeCl3加热易升华,则在沉积的无水FeCl3固体下方加热,使其升华,从而进入E装置中,E装置中冰水的作用是:冷凝,使FeCl3沉积,故答案为:在沉积的FeCl3固体下方加热;冷凝,使FeCl3沉积;
(4)由于Cl2会腐蚀橡胶,因此装置连接部分可都改成标准玻璃接口,不用橡胶连接件;同时,Cl2有毒,直接排放到空气中会造成污染,所以该套装置应在最后接上盛有NaOH溶液的洗气瓶(增加用NaOH溶液吸收尾气的装置),故答案为:氯气会腐蚀橡胶连接件;在最后接上盛有NaOH溶液的洗气瓶(增加用NaOH溶液吸收尾气的装置);
(5)FeCl2中Fe2+具有还原性,可与强氧化性物质(如酸性高锰酸钾溶液)反应,则可通过向F的样液中滴入1~2滴酸性KMnO4溶液,观察溶液不显红色来判断F中FeCl2未被完全氧化,故答案为:取样,滴入1~2滴酸性KMnO4溶液,溶液不显红色。