题目内容
1.(1)Na2O2用于呼吸面具供氧的化学方程式是2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2(任写一个)(2)用铂丝蘸取少量NaOH溶液进行焰色反应,其火焰呈黄色.
(3)检验某未知溶液是否含有SO42-所用的试剂是盐酸和氯化钡溶液.
(4)将铝片投入氢氧化钠溶液中,其反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 (1)过氧化钠与二氧化碳反应生成碳酸钠和氧气;与水反应生成氢氧化钠和氧气;
(2)钠的焰色反应为黄色;
(3)证明某未知溶液中含有SO42-离子,而不含有Ag+、碳酸根离子,要排除银离子、碳酸根离子的干扰;
(4)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:(1)过氧化钠与二氧化碳反应生成碳酸钠和氧气;与水反应生成氢氧化钠和氧气,化学方程式分别为:2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2;
故答案为:2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2;
(2)NaOH溶液含有钠元素,其焰色反应为黄色;
故答案为:黄;
(3)证明某未知溶液中含有SO42-离子,而不含有Ag+、碳酸根离子、亚硫酸根离子,要排除银离子、碳酸根离子、亚硫酸根离子的干扰,应先加入足量的盐酸,若无明显现象,再加入氯化钡溶液,产生白色沉淀,即可证明含有硫酸根离子;
故答案为:盐酸和氯化钡溶液;
(4)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
点评 本题考查了离子方程式、化学方程式的书写、离子的检验,明确反应实质是解题关键,注意离子检验实验设计的严密性,注意焰色反应为元素的物理性质,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
16.实验室需1mol•L-1的CuSO4溶液750mL,配制时应选用的容量瓶的规格和称取CuSO4的质量分别为( )
| A. | 容量瓶:500mL、250mL各一个;CuSO4:共120g | |
| B. | 容量瓶:750mL;CuSO4:120g | |
| C. | 容量瓶:1000mL;CuSO4•5H2O:160g | |
| D. | 容量瓶:1000mL;CuSO4:160g |
6.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,E反应物<E生成物 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)△H=+178.5 kJ•mol-1,E反应物<E生成物 | |
| C. | HI(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5 kJ•mol-1,1 mol HI在密闭容器中分解后放出26.5 kJ的热量 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.2 kJ•mol-1,含1 mol NaOH水溶液与含0.5 mol的浓硫酸混合后放热57.2 kJ |
13.关于下列各装置图的叙述中,正确的是( )
| A. | 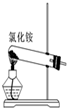 实验室用如图装置制取氨气 | |
| B. |  装置可用于制备氢氧化亚铁并观察其颜色 | |
| C. | 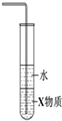 如图装置中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| D. | 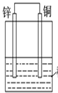 如图装置是原电池,锌电极为负极,发生还原反应 |
10.我国已成功研发出133Cs原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列.下列关于铯的说法中不正确的是( )
| A. | 氢氧化铯的碱性非常强 | |
| B. | 碱金属单质中铯的沸点最低 | |
| C. | 将一小块铯投入水中,实验现象与钠和水反应的完全相同 | |
| D. | 铯可以与很多非金属反应,形成离子化合物 |
11.石墨烯可看作将石墨的层状结构一层一层地剥开得到的单层碳原子;石墨炔是平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能;将氢气氢化到石墨烯排列的六角晶格中,使每个碳原子都 增加一个氢原子可得最薄的绝缘新材料石墨烷.下列有关说法中正确的是( )
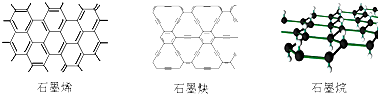

| A. | 石墨烯、石墨炔和石墨烷互为同素异形体 | |
| B. | 12g石墨烯完全转变为石墨烷需氢气11.2L | |
| C. | 石墨炔可作半导体材料,有望替代二氧化硅 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
 某温度下,在恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度均为0.20mol/L,发生反应:H2(g)+CO2(g)?H2O(g)+CO(g).CO(g)的浓度随时间变化如图所示.
某温度下,在恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度均为0.20mol/L,发生反应:H2(g)+CO2(g)?H2O(g)+CO(g).CO(g)的浓度随时间变化如图所示.