题目内容
15.对于某些离子的检验及结论一定正确的是( )| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| D. | 加入KSCN溶液,出现血红色,一定不含Fe2+ |
分析 A.白色沉淀可能为AgCl;
B.气体能使湿润红色石蕊试纸变蓝,气体为氨气;
C.气体可能为二氧化硫;
D.铁离子遇KSCN溶液为血红色.
解答 解:A.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,可能有SO42-或银离子,但二者不能同时存在,故A错误;
B.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,气体为氨气,可知原溶液中一定有NH4+,故B正确;
C.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,原溶液可能有CO32-或HCO3-、SO32-等,故C错误;
D.加入KSCN溶液,出现血红色,一定含Fe3+,不能确定是否含Fe2+,故D错误;
故选B.
点评 本题考查常见离子的鉴别,为高频考点,把握常见离子检验的试剂、现象与结论为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
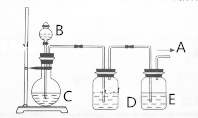
5.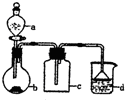 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是
( )
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是| 选项 | A中的物质 | b中的物质 | c中的物质 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO | H2O |
| D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
6.下列各组混合物中,能用分液漏斗进行分离的是( )
| A. | 酒精和水 | B. | 碘和酒精 | C. | 水和CCl4 | D. | 汽油和植物油 |
10.海水开发利用的部分过程如图所示.下列说法错误的是( )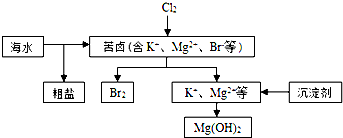

| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 富集溴一般先用空气和水蒸气吹出单质溴,在用SO2将其还原吸收 | |
| D. | 工业生产中常选用NaOH作为沉淀剂 |
7.下列离子方程式书写正确的是 ( )
| A. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓ |
4.为了探究FeS04和Cu(N03)2的混合物中各组分的含量,现设计如下流程.下列叙述中错误的是( ) 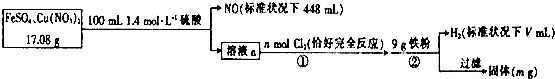

| A. | V=2240 | |
| B. | n=0.02 | |
| C. | 原混合物中FeS04的质量分数约为89% | |
| D. | m=0.6 |
5.A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如图所示,其中Z元素原子最外层电子数是电子层数的2倍.请回答下列问题:
(1)W的最高价氧化物化学式是Cl2O7;Z 的原子结构示意图为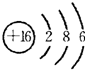 .
.
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O.
(3)AW3可用于净水,其原理是Al3++3H2O?Al(OH)3(胶体)+3H+.(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应.下列措施中既能提高反应速率,又能提高原料转化率的是d.
a.升高温度 b.加入催化剂
c.将 X的简单气态氢化物及时移离 d.增大反应体系的压强
(5)标准状况下,2.24 L X的简单气态氢化物被200 mL 1 mol•L-1 X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示)c(NO3-)>c(H+)>c(NH4+)>c(OH-).
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用 WY2(沸点9.9℃)氧化除去CN-的离子方程式2ClO2+2CN-═N2+2CO2+2Cl-.
| X | Y | |
| Z | W |
 .
.(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O.
(3)AW3可用于净水,其原理是Al3++3H2O?Al(OH)3(胶体)+3H+.(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应.下列措施中既能提高反应速率,又能提高原料转化率的是d.
a.升高温度 b.加入催化剂
c.将 X的简单气态氢化物及时移离 d.增大反应体系的压强
(5)标准状况下,2.24 L X的简单气态氢化物被200 mL 1 mol•L-1 X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示)c(NO3-)>c(H+)>c(NH4+)>c(OH-).
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用 WY2(沸点9.9℃)氧化除去CN-的离子方程式2ClO2+2CN-═N2+2CO2+2Cl-.