题目内容
3.A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物,A的单质常温下为密度最小的气体;B与Z的最外层电子数之比为2:3,常见化合物Y2X2是淡黄色固体,能与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.(1)Y的原子结构示意图为
 ; Z在周期表中的位置是第三周期ⅥA族;B元素的名称为碳.
; Z在周期表中的位置是第三周期ⅥA族;B元素的名称为碳.(2)化合物Y2X2属于A(填序号).
A.离子化合物 B.共价化合物
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为H2O2+H2S=S↓+2H2O.
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入氧气(填物质名称);放电时KOH溶液中的OH-往负极方向移动(填正或负).
(5)1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km.为了有效发展民用氢能源,首先必须制得廉价的氢气.下列可供开发、较经济又具有广阔前景的制氢方法是①(填写编号)
①光解海水 ②锌和稀硫酸反应.
分析 常见的10电子化合物有CH4、NH3、H2O、HF等,多为氢化物,A与B和A与X均可形成10个电子化合物,则A为H元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,则该化合物为Na2O2,其中Y为Na元素,X为O元素,X与Z同主族,则Z为S元素,最外层电子数为6,B与Z的最外层电子数之比为2:3,则B的最外层电子数为4,根据A、B、X、Y和Z是原子序数依次递增可知B为C元素,根据元素所在周期表中的位置,原子结构以及对应化合物的性质解答该题.
解答 解:常见的10电子化合物有CH4、NH3、H2O、HF等,多为氢化物,A与B和A与X均可形成10个电子化合物,则A为H元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,则该化合物为Na2O2,其中Y为Na元素,X为O元素,X与Z同主族,则Z为S元素,最外层电子数为6,B与Z的最外层电子数之比为2:3,则B的最外层电子数为4,根据A、B、X、Y和Z是原子序数依次递增可知B为C元素,
(1)Y为Na元素,钠离子的核电荷数为11,核外电子总数为10,其离子结构示意图为: ;Z为S元素,原子核外有3个电子层,最外层电子数为6,位于周期表第三周期ⅥA族;B为C元素,名称为碳,
;Z为S元素,原子核外有3个电子层,最外层电子数为6,位于周期表第三周期ⅥA族;B为C元素,名称为碳,
故答案为: ;第三周期ⅥA族;碳;
;第三周期ⅥA族;碳;
(2)化合物Y2X2为Na2O2,其电子式为 ,属于离子化合物,故A正确,
,属于离子化合物,故A正确,
故答案为:A;
(3)A与X和A与Z形成的18电子化合物分别为H2O2、H2S,其中H2O2具有氧化性,H2S具有还原性,二者发生氧化还原反应生成S和H2O,反应的化学方程式为:H2O2+H2S=S↓+2H2O,
故答案为:H2O2+H2S=S↓+2H2O;
(4)碱性氢氧燃料电池中,通入氢气的一极为电源的负极,通入氧气的一极为电源的正极;氢氧根离子带负电荷,其移动方向与电流方向相反,电解质溶液中,电流从负极流向正极,则氢氧根离子向负极移动,
故答案为:氧气;负;
(5)①光解海水,可充分利用光能,廉价而又低碳,符合要求,故①正确;
②锌和稀硫酸反应,消耗大量的锌和硫酸,不符合廉价的要求,故②错误;
故答案为:①.
点评 本题考查元素位置结构性质的关系及应用,题目难度中等,本题侧重于物质的结构和性质的考查,学习中注重相关基础知识的积累,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

 转变为
转变为 的方法为( )
的方法为( )| A. | 与足量NaOH溶液共热后,再通入CO2 | |
| B. | 与稀H2SO4共热后,加入足量Na2CO3 | |
| C. | 与稀H2SO4共热后,加入足量NaOH | |
| D. | 与足量NaOH溶液共热后,再加入稀硫酸 |
| A. | HCl的电子式H:Cl | B. | HClO的结构式:H-Cl-O | ||
| C. | Cl-的结构示意图: | D. | 质量数为37的氯原子:37Cl |
| A. | N2的电子式: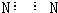 | B. | S2-的结构示意图: | ||
| C. | 次氯酸的结构式:H-O-Cl | D. | ${\;}_{40}^{65}$Zr和${\;}_{40}^{67}$Zr是同种核素 |
| A. | ${\;}_{53}^{131}$I元素中含中子数为53 | |
| B. | 它是碘元素的一种同位素 | |
| C. | ${\;}_{53}^{131}$I2的摩尔质量为262 g | |
| D. | 由此可确定碘元素相对原子质量为131 |
| A. | 在氧化还原反应中,甲比乙失电子多 | |
| B. | 同价态的阳离子,甲比乙氧化性强 | |
| C. | 甲能与稀硫酸反应生成氢气而乙不能 | |
| D. | 甲的最高价氧化物的水化物的碱性弱 |
| A. | Cl2、Br2、I2的熔点 | B. | Cl2、Br2、I2的相对分子质量 | ||
| C. | HCl、HBr、HI的酸性 | D. | 氢化物HCl、HBr、HI的热稳定性 |
①加成反应 ②水解反应 ③酯化反应 ④中和反应 ⑤氧化反应.
| A. | 只有①③ | B. | 只有②③④ | C. | 只有①③④⑤ | D. | 全部 |
| 序号 | 实验内容 | 实验目的 |
| A | 用石墨电极电解Mg(NO3)2、Pb( NO3)2 的混合液 | 比较确定铅和镁的金属活动性强弱 |
| B | 测相同温度下饱和Na2CO3溶液和饱和Na2SiO3溶液的pH | 确定碳和硅两元素非金属性强弱 |
| C | 室温下,用pH计测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |