题目内容
8.下列叙述中,表明金属甲的活泼性比金属乙的活泼性强的是( )| A. | 在氧化还原反应中,甲比乙失电子多 | |
| B. | 同价态的阳离子,甲比乙氧化性强 | |
| C. | 甲能与稀硫酸反应生成氢气而乙不能 | |
| D. | 甲的最高价氧化物的水化物的碱性弱 |
分析 元素的金属性强弱判断方法有:金属的金属性越强,其单质的还原性越强,其单质与水或酸反应生成氢气越容易;根据金属之间的置换反应,金属的金属性越强,其最高价氧化物的水化物碱性越强,据此分析解答.
解答 解:A.失电子多少与金属性强弱无关,如每个原子失电子时,铝比镁失电子多,但金属性镁大于铝,故A错误;
B.金属的金属性越强,其简单阳离子的氧化性越弱,同价态的阳离子,甲比乙氧化性强,则甲单质的还原性比乙弱,则金属性乙>甲,故B错误;
C.甲能与稀硫酸反应生成氢气而乙不能,说明甲的活泼性大于乙,则甲的金属性大于乙,故C正确;
D.甲的最高价氧化物的水化物的碱性弱,说明甲的金属性小于乙,故D错误;
故选C.
点评 本题考查金属性强弱判断,明确金属性强弱判断方法是解本题关键,注意不能根据失电子多少判断,要根据失电子难易程度判断,易错选项是A.

练习册系列答案
相关题目
18.对一个有气体参与的反应,下列能加快反应速率且不改变活化分子百分数的是( )
| A. | 定容容器中通入惰性气体 | B. | 增大压强 | ||
| C. | 升温 | D. | 加入催化剂 |
19.分子式为C3H8O的醇与C4H8O2的羧酸浓H2SO4存在时共热生成的酯有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
20.苹果酸的结构简式为 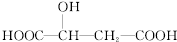 ,下列说法正确的是( )
,下列说法正确的是( )
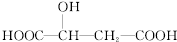 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1mol苹果酸可与3 mol NaOH发生中和反应 | |
| B. | 1mol苹果酸与足量金属Na反应生成1mol H2 | |
| C. | 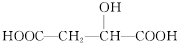 与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
17.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且有些可以再生.下列属于最有希望的新能源的是( )
①天然气 ②煤 ③核能 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能.
①天然气 ②煤 ③核能 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能.
| A. | ①②③④ | B. | ②⑤⑥⑦ | C. | ①③④⑤⑥ | D. | 除①②外 |
18.下列的实验事实和解释或结论都正确的是( )
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g)?4NO2(g)+O2(g)△H>0 在室温下能自发进行 | 这是一个熵增的反应 |
| B | 向0.1mol•L-1的氨水中通入少量氨气,溶液的pH减小 | 电离平衡向逆方向移动,溶液中的c(OH-) 减小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
| A. | A | B. | B | C. | C | D. | D |

 ; Z在周期表中的位置是第三周期ⅥA族;B元素的名称为碳.
; Z在周期表中的位置是第三周期ⅥA族;B元素的名称为碳. ,它可能的结构数目是( )
,它可能的结构数目是( )