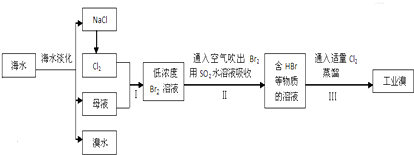
题目内容
有三种物质AC2、B2C2、AD4,第二周期元素A的最高正价和最低负价的绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子电子层结构与氩原子相同,则:
(1)A、B的元素名称分别为 、 .
(2)AD4分子其中含有的化学键类型为 键(选填“极性”或“非极性”).
(3)D的负一价阴离子的电子排布式为 ,B2C2的电子式为 ,属 (填“离子化合物”或“共价化合物”).
(1)A、B的元素名称分别为
(2)AD4分子其中含有的化学键类型为
(3)D的负一价阴离子的电子排布式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:有三种物质AC2、B2C2、AD4,元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2,可推知B为Na,C为O,淡黄色固体B2C2为Na2O2;第二周期元素A的最高正价和最低负价的绝对值相等,则A为碳元素,物质AC2为CO2;元素D的负一价阴离子电子层结构与氩原子相同,则D为Cl,物质AD4为CCl4,据此解答.
解答:
解:有三种物质AC2、B2C2、AD4,元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2,可推知B为Na,C为O,淡黄色固体B2C2为Na2O2;第二周期元素A的最高正价和最低负价的绝对值相等,则A为碳元素,物质AC2为CO2;元素D的负一价阴离子电子层结构与氩原子相同,则D为Cl,物质AD4为CCl4,
(1)由上述分析可知,A、B的元素名称分别为:碳、钠,故答案为:碳;钠;
(2)CCl4分子其中含有的化学键类型为:极性键,故答案为:极性;
(3)Cl-离子的电子排布式为1s22s22p63s23p6,Na2O2的电子式为 ,属于离子化合物,
,属于离子化合物,
故答案为:1s22s22p63s23p6; ;离子化合物.
;离子化合物.
(1)由上述分析可知,A、B的元素名称分别为:碳、钠,故答案为:碳;钠;
(2)CCl4分子其中含有的化学键类型为:极性键,故答案为:极性;
(3)Cl-离子的电子排布式为1s22s22p63s23p6,Na2O2的电子式为
 ,属于离子化合物,
,属于离子化合物,故答案为:1s22s22p63s23p6;
 ;离子化合物.
;离子化合物.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,侧重对基础知识的巩固,难度不大.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、熔化状态下能导电的物质一定是离子化合物 |
| B、离子化合物不可能只含非金属元素 |
| C、离子化合物均能溶于水 |
| D、离子化合物在一定条件下可以转化成分子 |
室温下,下列各组离子在指定溶液中能大量共存的是( )
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| B、加入甲基橙试液呈红色的溶液:NH4+,K+,SO42-,Cl- |
| C、Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
| D、pH=12的溶液中:NO3-、I-、Na+、Al3+ |
 元素A的单质及元素A与元素B形成的化合物有如图所示的转化关系:
元素A的单质及元素A与元素B形成的化合物有如图所示的转化关系: