题目内容
8.向甲乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同条件下(温度T℃),发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示: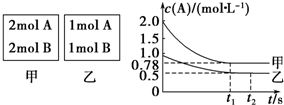
(1)乙容器中,平衡后物质A的转化率为50%
(2)x=1
(3)T℃时该反应的平衡常数为2
(4)下列说法中正确的是C
A、向平衡后的乙容器中充入氦气可使重新达到平衡时的c(A)增大
B、将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内相同
C、若向甲容器中再充入2mol A、2mol B,则平衡时甲容器中A的浓度范围为0.78mol•L-1<c(A)<1.56mol•L-1.
分析 (1)乙容器中,A参加反应的物质的量=(1-0.5)mol/L×1L=0.5mol,根据A和B的关系式知,参加反应的B的物质的量也是0.5mol,则B的转化率=$\frac{0.5mol/L}{1mol/L}×100%$;
(2)计算甲、乙容器中A的转化率,再根据压强对A转化率的影响来确定x值;
(3)根据化学平衡常数K=$\frac{c(C)}{c(A).c(B)}$;
(4)A.A的浓度不变,则平衡不移动;
B.升高温度,平衡向吸热反应方向移动;
C.若向甲容器中再充入2molA、2molB,相当于增大压强,A在转化率比原来大.
解答 解:(1)乙容器中,A参加反应的物质的量=(1-0.5)mol/L×1L=0.5mol,根据A和B的关系式知,参加反应的B的物质的量也是0.5mol,则B的转化率=$\frac{0.5mol/L}{1mol/L}×100%$=50%,故答案为:50%;
(2)甲容器反应达到平衡后,c(A)=0.78 mol•L-1,A的转化率=$\frac{(2.0-0.78)mol/L}{2mol/L}×100%$=61%,乙容器中,A参加反应的物质的量=(1-0.5)mol/L×1L=0.5mol,A的转化率=$\frac{0.5mol/L}{1mol/L}×100%$=50%,即压强越大,A的转化率越高,所以正反应为气体体积减小的反应,则x=1,故答案为:1;
(3)反应达到平衡时,乙容器中c(A)=c(B)=c(C)=0.5 mol•L-1,T℃时,该反应的平衡常数K=$\frac{c(C)}{c(A).c(B)}$=$\frac{0.5}{0.5×0.5}$=2,故答案为:2;
(4)A.向平衡后的乙容器中充入惰性气体氦气,气体的浓度不变,平衡不发生移动,所以c(A)不变,故A错误;
B.将乙容器单独升温,平衡逆向移动,A的体积分数增大,更大于甲容器中A的体积分数,故B错误;
C.若向甲容器中再充入2 mol A、2 mol B,相当于增大压强,平衡向正反应方向移动,则达到平衡时A的转化率比不加前增大,所以平衡时甲容器中0.78 mol•L-1<c(A)<1.56 mol•L-1,故C正确;
故答案为:C.
点评 本题考查了化学平衡的移动、化学平衡的计算、等效平衡等知识点,根据图象计算转化率,根据转化率计算x值,再结合等效平衡及影响化学平衡的因素来分析(4),注意等效平衡的应用,难度中等.

 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.(1)加热前,通常需要在试管Ⅰ中加入碎瓷片,目的是防止暴沸.
(2)为了证明浓硫酸的作用,某同学进行了以下4个实验,实验记录如表:
| 实验 编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL3mol•L-1硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、6mL6mol•L-1盐酸 | 饱和Na2CO3溶液 | 1.2 |
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是催化剂、吸水剂;实验D和实验C对照,你又能得出的结论是对该反应起催化作用的实际上为H+.
(3)饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、降低酯在水中的溶解度,容易分层.
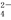 、NO
、NO
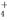 、Cl-、S2-
、Cl-、S2-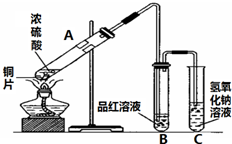 图是进行铜与浓硫酸反应并进行产物检验的装置.
图是进行铜与浓硫酸反应并进行产物检验的装置.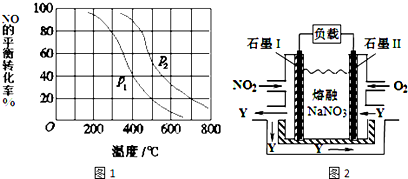
 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题: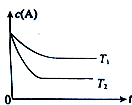 运用所学知识,解决下列问题:
运用所学知识,解决下列问题:
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: