题目内容
15.下列说法不正确的是( )| A. | 只有碳、氢两种元素组成的有机化合物称为烃 | |
| B. | 甲醛和苯甲醛互为同系物 | |
| C. | 烯烃中的碳碳双键为烯烃的官能团 | |
| D. | 乙醇和乙二醇都属于醇类 |
分析 A.烃类化合物是碳、氢两种元素组成的有机化合物;
B.结构相似,组成相差CH2的有机物互称为同系物;
C.烯烃是指含碳碳双键的链状烃类有机物;
D.羟基和链烃基连接形成的有机物为醇类化合物,依据羟基个数分为一元醇、二元醇、三元醇等.
解答 解:A.只有碳、氢两种元素组成的有机化合物称为烃,故A正确;
B.甲醛和苯甲醛含有相同官能团醛基,连接的烃基结构不同,不能互为同系物,故B错误;
C.烯烃中的官能团是碳碳双键,官能团决定物质的性质,故C正确;
D.乙醇和乙二醇中都含有醇羟基,都属于醇类,故D正确;
故选B.
点评 本题考查有机物的概念、结构、分类等知识点,明确概念实质是解本题关键,题目难度不大.

练习册系列答案
相关题目
6.下列化学用语表达不正确的是( )
| A. | 次氯酸的电子式: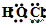 | |
| B. | 质子数为6、质量数为14的原子:${\;}_6^{14}N$ | |
| C. | CS2的结构式:S=C=S | |
| D. | 氯的原子结构示意图: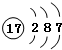 |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2L氟化氢中含有分子的数目为0.5NA | |
| B. | 常温下a克某烷烃(CnH2n+2)中含有共用电子对数目为$\frac{a}{14n+2}$(3n+1)NA | |
| C. | 56g 聚乙烯中含有碳碳双键的数目为2NA | |
| D. | 常温下,0.2mol/L的FeCl3溶液中含Cl-数目为0.6NA |
10.下列说法正确的是( )
| A. | 煤的干馏是物理变化 | |
| B. | 石油裂解的目的主要是为了提高汽油的产量和质量 | |
| C. | 石油分馏能得到不同沸点范围的产物 | |
| D. | 石油裂化主要得到的是乙烯、丙烯等 |
20.下列说法正确的是(NA 表示阿伏加德罗常数的值)( )
| A. | 16.9 克过氧化钡(BaO2)固体中阴阳离子总数为0.3NA | |
| B. | 标准状况下,11.2L CHCl3中所含有的原子总数为2.5NA | |
| C. | 一定条件下,2.6 g 乙炔、苯的气态混合物中所含碳原子数为0.2NA | |
| D. | 1 mol 甲基与1mol 羟基所含电子数均为10 NA 个 |
7.下列有关合金的说法不正确的是( )
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 合金的熔点一般比其各成分金属的熔点低 | |
| C. | 铝钠合金投入到足量氯化铜溶液中,可能有铜析出 | |
| D. | mg不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则钠的质量分数越大 |
4.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图1所示:

(1)从反应开始到10s,用Z表示的反应速率为0.079mol/(L•s).
(2)该反应的化学方程式为X+Y?2Z.
(3)10s后的某一时刻(t1)改变了外界条件,其反应速率随时间的变化图象如图2所示:则下列说法符合该图象的是CD
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
(4)其化学平衡常数K和温度t的关系如表:
由此判断该反应为放热反应(填“吸热”或“放热”).
(5)根据以上反应特点,为使反应的反应速率增大,且平衡向正反应方向移动,可采取的措施是ce.
a.及时分离出Z气体 b.适当提高温度 c.增大Y的浓度
d.选择高效的催化剂 e.使容器体积收缩,增大压强 f.适当降低温度.

(1)从反应开始到10s,用Z表示的反应速率为0.079mol/(L•s).
(2)该反应的化学方程式为X+Y?2Z.
(3)10s后的某一时刻(t1)改变了外界条件,其反应速率随时间的变化图象如图2所示:则下列说法符合该图象的是CD
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
(4)其化学平衡常数K和温度t的关系如表:
| t/℃ | 700 | 800 | 830 | 1000 |
| K | 20 | 10 | 1.0 | 0.5 |
(5)根据以上反应特点,为使反应的反应速率增大,且平衡向正反应方向移动,可采取的措施是ce.
a.及时分离出Z气体 b.适当提高温度 c.增大Y的浓度
d.选择高效的催化剂 e.使容器体积收缩,增大压强 f.适当降低温度.